| 【干货】中心原子杂化轨道类型的判断方法! | 您所在的位置:网站首页 › 高中杂化轨道计算公式 › 【干货】中心原子杂化轨道类型的判断方法! |
【干货】中心原子杂化轨道类型的判断方法!
|
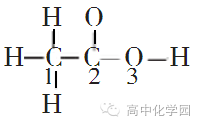
1.价电子对数n=[中心原子(A)的价电子数+配位原子(B)提供的价电子数×m]÷2 2. 对于主族元素,中心原子(A)的价电子数=最外层电子数;配位原子中卤族原子、氢原子提供1个价电子,氧族元素的原子按不提供电子计算;离子在计算价电子对数时,还应加上负离子的电荷数或减去正离子的电荷数。 3.中心原子孤电子对数=n(价电子对数)-m(配位原子 B 数)。 4.杂化轨道由形成 σ 键的电子对和孤电子对占据,因此分子或离子的空间构型为杂化轨道构型去掉孤电子对后剩余的形状。 例如:指出下列分子或离子的中心match原子的杂化轨道类型,并预测它们的空间构型: ⑴ BeCl2、 H2O、 ⑵ SO3、 NH3、 ⑶ NH4+、 PO43-。 解析:第⑴组都是 AB2型分子, BeCl2的价电子对数 n=( 2+ 1× 2)÷ 2= 2, Be 采用 sp 杂化, n- m= 2- 2= 0,无孤电子对, 故分子呈直线型; H2O 的价电子对数 n=( 6+ 1× 2)÷ 2= 4, O 采用 sp3 杂化, n- m= 4- 2= 2,有 2 对孤电子对,故分子呈折线型。 第⑵组都是 AB3 型分子, SO3 的价电子对数 n=( 6+ 0×3 )÷2 =3 ,S 采用 sp2 杂化, n-m =3 -3 =0 , 无孤电子对,故分子呈平面三角形;NH3 的价电子对数 n=(5 +1×3 )÷2 =4 ,N 采用 sp3 杂化, n-m =4 -3 =1 ,有 1 对孤电子对,故分子呈三角锥型。 第⑶组都是 AB4 型离子,NH4 +的价电子对数 n=(5 +1×4 -1 )÷2 =4 ,N 采用 sp3 杂化, n-m =4 -4 =0 ,无孤电子对,故分子呈正四面体;PO43 -的价电子对数 n=(5 +0×3 +3 )÷2 =4 ,P 采用 sp3 杂化, n-m =4 -4 =0 ,无孤电子对,分子呈正四面体结构。 三、根据 σ 键数和孤电子对数逆向判断 根据价层电子对互斥理论,中心原子价电子对数=σ 键数+孤电子对数,如果我们已知 σ 键数和孤电子对数,就可以逆向判断出中心原子价电子对数,从而判断出杂化方式。 例如: 指出乙酸分子中标出原子的杂化轨道类型以及它们周围原子的空间分布情况。
解析: 高中学生都能熟练书写有机分子的结构式,根据结构式就很容易得知 σ 键数和孤电子对数,从而判断出杂化方式。 1 号 C 形成 4 个 σ 键,无孤电子对,所以有 4 个价电子对,C 原子为 sp3 杂化,其周围 3 个 H 和 1 个 C 呈正四面体分布;2 号 C 形成 3 个 σ 键,无孤电子对,所以有 3 个价电子对,C 原子为 sp2 杂化,其周围的 C 、O 、O 呈正三角形分布;3 号 O 形成 2 个 σ 键,2 个孤电子对, 所以有 4 个价电子对,C 原子为 sp3 杂化,其周围的 C 和 H 呈折线形分布。 四、根据等电子原理判断 教材的“资料卡”中介绍了等电子原理,即具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这里的结构特征包括中心原子的杂化轨道类型、分子的空间结构等。因此,我们可以根据一些熟悉的分子的杂化轨道类型来判断与它互为等电子体的不熟悉的分子的杂化轨道类型。 例如:指出 N2O 分子的空间构型和杂化轨道类型。 解析:教材中介绍的价层电子对互斥理论是比较浅显的,并没有介绍 N 作为配位原子应该如何计算价电子对数,在解决这样的题目时,教师不必加深补充介绍价层电子对互斥理论, 可以采用等电子原理巧解。 因为N2O 与 CO2 互为等电子体,学生对于 CO2 的结构非常熟悉,直接根据直线型,判断出 sp 杂化,当然也可以计算出 CO2 中的 C 原子的价电子对数 n=(4 +0×2 )÷2 =2 ,判断 出 sp 杂化,直线型,所以 N2O 也应为 sp 杂化,直线型。 同样, 如果要判断 CNS -的空间构型和杂化轨道类型,我们大可不必研究究竟哪个原子是中心原子,哪个是配位原子,如何计算价电子对数,直接根据 CNS -与CO2 等电子体,来判断 CNS -为直线型,sp 杂化。 五、根据结构代换判断 有机化学中的取代反应是指有机物分子里某些原子或原子团被其它原子或原子团所代替的反应,根据取代反应机理,发生取代后,其中心原子的结构和成键方式都应该不变。 由此启发,对于一些复杂的分子,我们可以将其中的某些原子团代换成原子,变成简单熟悉的分子,根据这个分子的空间构型和杂化轨道类型,来判断原来的分子的空间构型和杂化轨道类型。 例如: CH3 -OH 等醇类,都可以看作 R—代换了 H2O中的 H , 因为 H2O 中 O 原子为 sp3 杂化, 所以 CH3 -OH 中的 O 原子也为 sp3 杂化。 H2N -NH2 可以看作-NH2 代换了 NH3 中的 H , 因为NH3 中 N 原子为 sp3 杂化,所以 H2N -NH2 中的 N 原子也为 sp3 杂化。返回搜狐,查看更多 |
【本文地址】