| Cell Metabolism:巨噬细胞外泌体又有新作用!促进胰岛素敏感性 | 您所在的位置:网站首页 › 巨噬细胞针剂有哪些成分 › Cell Metabolism:巨噬细胞外泌体又有新作用!促进胰岛素敏感性 |
Cell Metabolism:巨噬细胞外泌体又有新作用!促进胰岛素敏感性
|
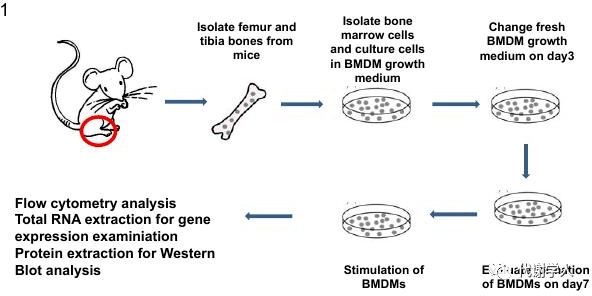
划重点啦! 1、M2巨噬细胞来源的外泌体(M2 Exos)可改善胰岛素抵抗 2、M2 Exos中的miRNA发挥胰岛素增敏作用 3、miR-690是M2 Exos内形成胰岛素增敏效应的miRNA 4、miR-690-Nadk轴调节炎症反应和胰岛素信号 研究结果 1 抗炎巨噬细胞来源的细胞外泌体可以减轻肥胖诱导的胰岛素抵抗 作者之前的研究表明,将瘦小鼠eWAT (附睾白色脂肪组织)中M2型ATM分泌的外泌体通过尾静脉注射的方式给予肥胖小鼠,可以提高肥胖小鼠的胰岛素敏感性。然而,由于瘦小鼠中的ATM相对较少,每处理1只肥胖小鼠需要收集20-25只瘦小鼠的外泌体,因此难以进行更深入的机制研究。为了克服这个难题,作者用IL4/IL13处理小鼠BMDMs(骨髓来源的巨噬细胞),在体外诱导BMDMs形成抗炎的M2巨噬细胞。接下来,作者提取了M2巨噬细胞分泌的外泌体(M2 Exos),并通过电镜、分子粒径和WB等技术进行了外泌体质量检测(图 S1A-S1C)。此外,作者通过尾静脉注射将PKH26标记的M2 Exos对肥胖小鼠进行体内给药,并检测给药后M2 Exos的体内分布情况,发现这些外泌体主要被肝脏、骨骼肌和脂肪组织吸收(图 S1D)。 小鼠BMDMs(骨髓来源的巨噬细胞)的分离、形成和刺激方案[2]。 简而言之,取材6-8周的小鼠的股骨和胫骨,使用包含2% FBS的PBS冲洗分离得到骨髓细胞,进一步使用NH4Cl溶液裂解红细胞后,即可获得BMDMs,培养7天后达到成熟状态。为了诱导巨噬细胞极化,可以使用LPS或LPS+IFNγ刺激诱导形成M1巨噬细胞,或使用IL-4和/或IL-13刺激诱导形成M2巨噬细胞。巨噬细胞诱导极化的效果可以根据细胞形态、表面标记物、细胞因子产生以及细胞信号通路激活的变化等进行评估。
为了进一步评估M2 Exos在体内行使的功能,作者将M2 Exos通过尾静脉注射的方式处理肥胖小鼠,并在4周后监测了肥胖小鼠的代谢表型,发现与注射空脂质体的对照组相比,M2 Exos处理虽然对小鼠体重和胰岛素分泌影响不大(图 S2A-B),但是可以显著改善小鼠的葡萄糖耐受不良和胰岛素敏感性(图 1A-B,图 S2C)。此外,研究也发现M2 Exos处理后,小鼠的肝脏、骨骼肌和脂肪组织中AKT磷酸化水平更高(胰岛素刺激会导致胞内AKT磷酸化)(图 1C-E)。
图1:M2 Exos处理可改善肥胖引起的葡萄糖耐受不良和胰岛素抵抗
附图1:M2 Exos的鉴定 为了进一步在体外验证M2 Exos对葡萄糖耐量和胰岛素敏感性的影响,作者发现,M2 Exos处理可以显著改善3T3-L1脂肪细胞和L6肌细胞的胰岛素敏感性(图 2A-B)。此外,胰高血糖素可以作用于肝细胞使肝糖原分解成葡萄糖,促进肝脏葡萄糖的输出,M2 Exos处理可以增强胰岛素介导的肝原代细胞中GCG(胰高血糖素刺激的葡萄糖输出)的抑制作用(图 2C)。与体内结果一致,M2 Exos处理也会导致脂肪细胞、肌细胞和肝细胞中AKT的磷酸化水平上升,进一步说明M2 Exos处理后会改善受体细胞的胰岛素敏感性(图 2D-E)。总之,这些结果表明,具有抗炎作用的M2巨噬细胞来源的外泌体能够减轻肥胖诱导的胰岛素抵抗现象。
图2:M2 Exos处理在体外改善细胞的胰岛素敏感性
2 M2 Exos中的miRNA对其发挥胰岛素增敏效应至关重要 外泌体包含多种内容物,包括miRNA、脂质和蛋白质等(想要了解更多的外泌体知识,请迈入传送门:外泌体第一弹/第二弹/第三弹)。为了研究M2 Exos中的miRNAs对上述表型的影响,作者构建了一个髓细胞特异性Dicer敲除(Dicer KO)的小鼠模型,Dicer是一种核酸内切酶,对于miRNA的生物学发生至关重要。不言而喻,Dicer KO小鼠的BMDMs中无法产生miRNA,其分泌的M2 Exos自然也无法装配miRNA。作者通过检测Dicer敲除前后M2 Exos中的miR-223的水平,证实了Dicer KO小鼠分泌的M2 Exos中不包含miRNA(注:miR-223是髓细胞特异性的miRNA,本文的M2巨噬细胞是髓细胞诱导分化而成,故M2 Exos中一定包含miR-233。此处的miR-223可理解为M2 Exos的miRNA内参)(图 S3A-B)。
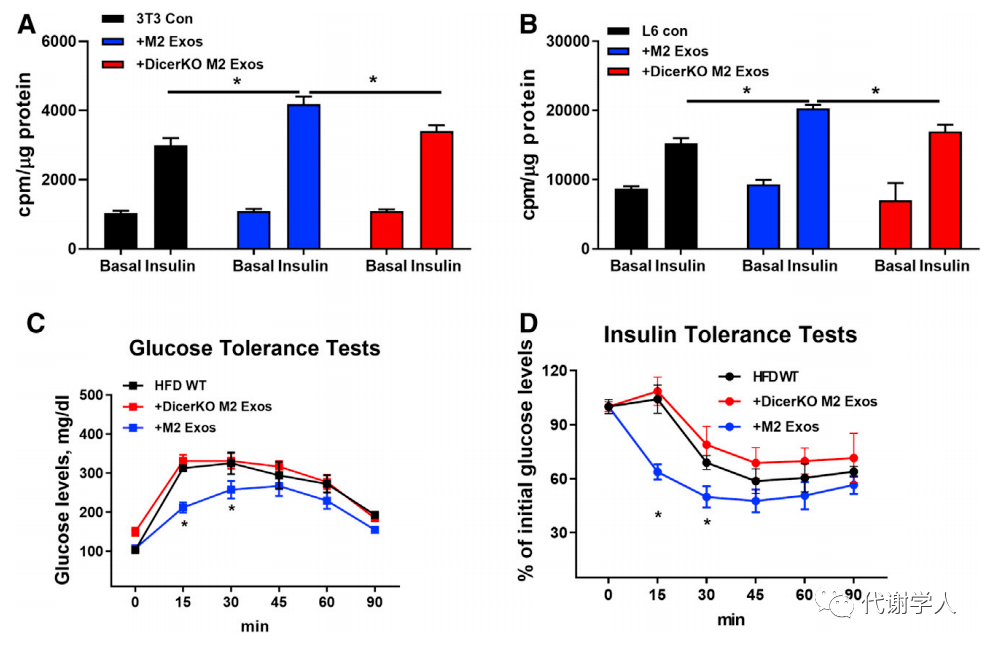
附图3:Dicer敲除对M2 Exos中miRNA丰度的影响 作者接下来收集了M2 Exos(野生型小鼠的M2 Exos)和Dicer KO M2 Exos(Dicer KO小鼠的M2 Exos)来处理3T3-L1脂肪细胞和L6肌细胞。结果发现,Dicer KO M2 Exos处理组胰岛素刺激的葡萄糖摄取能力减弱(图 3A-B)。作者还评估了两种外泌体对HFD(高脂饮食)饲养小鼠的影响,发现M2 Exos处理能显著增强胰岛素敏感性和葡萄糖耐量,而Dicer KO M2 Exos处理组小鼠则没有显著变化(图 3C-D)。这些数据表明,miRNAs是M2 Exos增强胰岛素敏感性的关键成分。
图3:miRNA是M2 Exos发挥效应的关键成分 3 M2 Exos中的miR-690可改善胰岛素敏感性 考虑到miRNA在M2 Exos中的关键作用,作者接下来对其开展了一系列的机制探索。之前的研究已经建立了M2-ATM-Exos(M2型脂肪组织巨噬细胞分泌的外泌体)的miRNA图谱[3],因此,作者在3T3-L1脂肪细胞中进行葡萄糖转运实验,检测M2 Exos中丰度较高的5个miRNA对胰岛素刺激的葡萄糖摄取的影响,排除了4个无显著影响的miRNA(图 S4A),并对miR-690展开进一步评估。研究发现,瘦小鼠分泌的M2 Exos中miR-690的丰度比肥胖小鼠的更高(图 S4B)。同时,M2 Exos中miR-690的丰度比M1和M0巨噬细胞(即未分化的巨噬细胞)的更高(图 S4C-D),甚至M2 Exos中的miR-690的丰度几乎与M2-ATM-Exos中的一致(图 S4B)。此外,作者还发现将M2 Exos注射肥胖小鼠后,其关键代谢组织中miR-690丰度变高(图 S4E)。 拓展阅读 M1巨噬细胞和M2巨噬细胞[4] M1巨噬细胞是可以产生促炎细胞因子的巨噬细胞,被称为经典型巨噬细胞。M1巨噬细胞的特征在于分泌细胞因子(如IL-1β、TNF、IL-12和IL-18)的能力强。M1巨噬细胞中,主要组织相容性复合体II类(MHC-II)、CD68和CD80、CD86共刺激分子高表达。当接受如下刺激时,可发生经典的巨噬细胞激活:(1)IFN-γ,主要由其他细胞类型(TH1细胞、细胞毒性T细胞和NK细胞)分泌; (2)脂多糖(LPS),革兰氏阴性细菌外膜的组分; (3)粒细胞-巨噬细胞集落刺激因子(GM-CSF),刺激产生促炎细胞因子。M1巨噬细胞具有吞噬大量病原体的能力,并能杀死细菌。然而,在特定条件下,M1巨噬细胞加剧了对健康有害的炎症反应。此外,值得注意的是,肥胖能促进巨噬细胞的极化从M2型向M1型转变。 M2巨噬细胞又称替代性活化巨噬细胞。已发现一些刺激因素如CSF-1、IL-4、IL-10、TGF-β和IL-13、真菌和蠕虫感染,这些因素有利于M2亚群分化。在组织重塑、血管生成和过敏性疾病中,M2巨噬细胞起着核心作用。M2巨噬细胞的特征在于表达巨噬细胞甘露糖受体(MMR),即CD206。但是单纯检测CD206的表达不能确认M2巨噬细胞,需配合其他标志物(如CMAF)联合确认。有研究表明,M2巨噬细胞能够修复组织损伤。 作者推测可能是M2 Exos中的miR-690发挥了胰岛素增敏效应,为了验证这一想法,作者使用了Cy3标记的miR-690 mimic对肥胖小鼠进行了尾静脉注射。结果发现,miR-690 mimic主要被肝脏、骨骼肌和脂肪组织等关键的代谢组织摄取(图 S4F-G)。与对照组相比,注射miR-690 mimic的肥胖小鼠的体重无明显变化(图 S4H),葡萄糖耐量和胰岛素敏感性得到显著改善,并且关键代谢组织中AKT的磷酸化水平也更高(图 4A-C),这些结果表明miR-690能够促进胰岛素信号转导。此外,与对照组相比,注射miR-690 mimic的肥胖小鼠中ATM细胞总数没有变化,但是M2型ATM的比例显著升高,促炎基因的表达显著降低(图 4D-E)。
图4:miR-690可改善肥胖诱导的葡萄糖耐受不良和胰岛素抵抗
附图4:MiR-690过表达的体内效应 在体外研究中,作者使用miR-690 mimic直接转染3T3-L1脂肪细胞和L6肌细胞,发现在胰岛素刺激后,两种细胞的葡萄糖摄取能力都显著上升(图 5A-B,S5A-B),此外,胰高血糖素刺激后,miR-690 mimic处理导致肥胖小鼠肝原代细胞中肝葡萄糖生成显著减少(图 5C,S5C)。胰岛素刺激的AKT磷酸化水平在miR-690 mimic处理的细胞中也更高(图 5D),与miR-690 inhibitor共转染则阻断了miR-690对3T3-L1脂肪细胞和原代肝细胞中的胰岛素增敏效应(图 5E,S5D-E),说明miR-690过表达使胰岛素信号增强。为了进一步了解miR-690的调控作用,作者对miR-690 过表达/对照的3T3-L1脂肪细胞进行了RNA-seq分析,并通过GO功能富集分析对差异表达基因进行分析,发现与对照组相比,miR-690过表达激活了JAK/STAT和胰岛素信号通路,并抑制谷胱甘肽代谢等通路(图 5E)。作者将miR-690 mimic转染到M0 BMDMs(即未分化的巨噬细胞)细胞后,发现细胞的抗炎基因表达增加,与之一致,LPS(脂多糖,能促进炎症)诱导的促炎表型也受到了抑制(图 5F-G)。
图5:miR-690增强细胞胰岛素敏感性
附图5:miR-690对细胞胰岛素反应的影响 作者推测miR-690 mimic的生物学效应与包含脂质及蛋白质的M2 Exos有一定区别,因为miR-690可能与外泌体中的其他分子协同作用以增强胰岛素信号转导。为了排除这种可能性,作者将miR-690 mimic转染到DicerKO小鼠的BMDMs后,提取了外泌体(后续命名为miR-690 Exos)。为了确定miR-690是否被包装进入了miR-690 Exos中,作者通过流式细胞术和qPCR实验进行了验证,证实miR-690 Exos中具有高丰度的miR-690分子(图S6A-C)。接着,为了评估miR-690 Exos对胰岛素敏感性的影响,作者将其通过尾静脉方式注射到肥胖小鼠,发现与对照组(注射DicerKO BMDM Exos的肥胖小鼠)相比,miR-690 Exos组(注射miR690 Exos的肥胖小鼠)的体重无差异(图 S6D),肝脏、骨骼肌以及脂肪组织中miR-690富集(图 S6E),并且糖耐量和胰岛素敏感性得到显著改善(图 6A-B)。胰高血糖素-血糖钳实验进一步说明miR-690 Exos处理可以改善胰岛素敏感性(图 6C),并且可以上调关键代谢组织中的AKT磷酸化水平(图 6D)。此外,miR-690 Exos处理可以提高抗炎M2-ATMs的比例,抑制促炎基因的表达(图 S6F-G)。作者还在体外进行了验证,miR-690 Exos处理可以显著提高3T3-L1脂肪细胞和肝原代细胞的miR-690水平(图 S6H),提高脂肪细胞中胰岛素刺激的葡萄糖摄取能力,抑制肝细胞中葡萄糖生成能力(图 6E-F)。总之,这些结果表明miR-690在体内和体外都有助于抗炎巨噬细胞外泌体对胰岛素敏感性的改善作用。
图6:miR-690过表达的外泌体可以改善胰岛素敏感性
附图6:miR-690在miR690 Exos中富集 4 Nadk是miR-690的靶基因,调控胰岛素信号转导 miRNAs通过与靶mRNA进行碱基互补配对阻断翻译和/或诱导靶mRNA降解来发挥其生物学作用。作者利用TargetScan Mouse 7.2软件预测了miR-690靶基因,并开展了实验验证。结果发现Nadk基因表达在miR-690过表达的3T3-L1脂肪细胞、L6肌细胞、肝原代细胞中均受到显著抑制(图 7A)。此外,含有miR-690 mimic的肥胖小鼠的肝脏、骨骼肌和脂肪组织中,Nadk的表达均显著降低(图 S7A-C)。转染miR-690 mimic后,人源HepG2肝细胞系中NADK的表达也降低(图 S7D)。荧光素酶报告基因实验也证明了Nadk是miR-690的靶mRNA(图 7B)。 拓展阅读 NADK知多少 NADK(NAD激酶) 能催化磷酸基团从ATP转移到NAD+(烟酰胺腺嘌呤二核苷酸)生成NADP+(烟酰胺腺嘌呤二核苷酸磷酸盐),然后再通过脱氢酶(如6-磷酸葡萄糖脱氢酶和苹果酸酶)将NADP+还原为NADPH(还原型烟酰胺腺嘌呤二核苷酸磷酸)。NADPH提供生物合成反应和氧化-还原所需的还原当量,在多种代谢和生物合成途径中起着重要的辅助因子的作用。比如,NADPH参与脂质和胆固醇合成过程。 接下来,作者评估了miR-690介导的Nadk抑制对胰岛素敏感性的重要性。作者通过siNadk转染方式敲低了3T3-L1脂肪细胞中的Nadk水平,胰岛素刺激后,细胞表现出的葡萄糖摄取增强(图 7C)。此外,通过siNadk敲低肥胖小鼠肝原代细胞中的Nadk水平,导致胰高血糖素刺激后肝葡萄糖生成减少(图 7D)。此外,Nadk水平的降低伴随着细胞内AKT磷酸化水平的升高(图 7E)。然而,与单独使用siNadk或miR-690 Exos的细胞相比,siNadk和miR-690 Exos的联合使用没有表现出胰岛素敏感性进一步改善的效果(图 S7E)。总之,这些数据表明miR-690-Nadk轴在调节胰岛素信号中发挥关键作用。在BMDMs中过表达miR-690后,也观察到Nadk表达水平的显著下降(图 S7F)。为了评估Nadk在调节巨噬细胞极化中的作用,作者用siRNA转染抑制BMDMs细胞中Nadk的表达。与miR-690 Exos处理或miR-690过表达观察到的ATMs表型一致,在LPS刺激下,Nadk的抑制使BMDMs中的促炎基因的表达水平下降(图 7F)。此外,在IL4/IL13处理后的BMDMs中抑制Nadk水平导致抗炎基因表达升高(图 7G)。 讨论 文章中是如何论述Nadk能够调控胰岛素抵抗的? 1. 首先,文章讨论部分提及,有研究表明,肥胖可以通过抑制NAD+的生物合成,提示用NAD+中间体治疗可以提高胰岛素敏感性; 2. Nadk能催化磷酸基团从ATP转移到NAD+(烟酰胺腺嘌呤二核苷酸)生成NADP+;所以,Nadk减少,可以增加NAD+的量; 3. M2 Exos中的miR-690可以改善肥胖小鼠的胰岛素敏感性 ; 4. Nadk是miR-690的靶基因; 总的来说,M2 Exos中的miR-690通过靶向Nadk,并抑制Nadk的表达,进而增加NAD+的水平,最终提高胰岛素敏感性。
图7:miR-690-Nadk轴在介导细胞胰岛素反应中发挥作用
附图7:MiR-690对Nadk表达的影响 总结
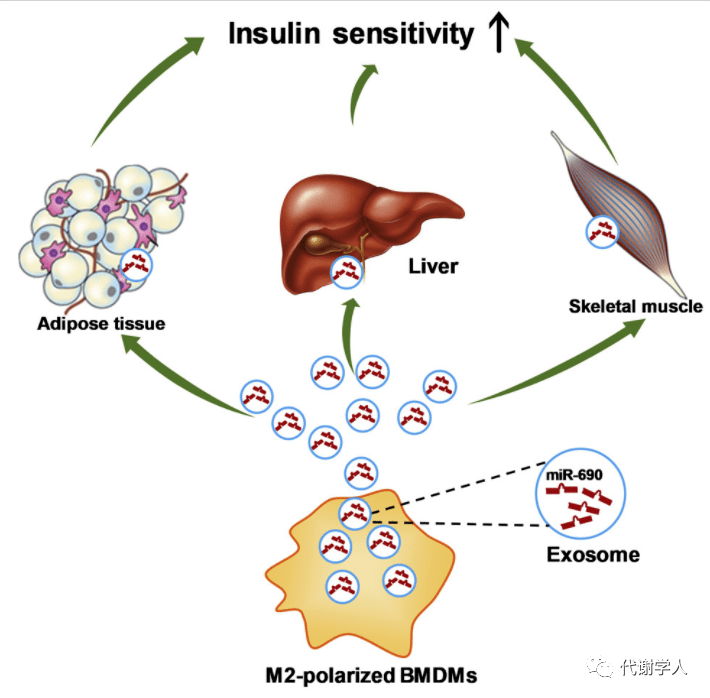
总之,本篇文章揭示了M2 Exos来源的miR-690对肥胖小鼠胰岛素敏感性的改善作用。M2 Exos由M2极化的巨噬细胞分泌,其中,M2巨噬细胞由IL4/IL13诱导BMDMs分化而成。在M2 Exos中,miR-690是发挥胰岛素增敏作用的主要效应分子。Nadk是miR-690在胞内的靶mRNA,miR-690-Nadk轴可以调控胰岛素信号通路。该研究成果有望应用于肥胖及相关代谢性疾病的治疗。
参考文献 [1] Wu D, Molofsky A B, Liang H E, et al. Eosinophils sustain adipose alternatively activated macrophages associated with glucose homeostasis[J]. Science, 2011, 332(6026): 243-247.2016;17(11):691-702 [2] Ying W, Cheruku P S, Bazer F W, et al. Investigation of macrophage polarization using bone marrow derived macrophages[J]. J Vis Exp, 2013, (76). [3] Ying W, Riopel M, Bandyopadhyay G, et al. Adipose Tissue Macrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro Insulin Sensitivity[J]. Cell, 2017, 171(2): 372-384.e312. [4] Nahrendorf M, Swirski F K. Abandoning M1/M2 for a Network Model of Macrophage Function[J]. Circ Res, 2016, 119(3): 414-417.返回搜狐,查看更多 |
【本文地址】



 附图2:M2 Exos的体内效应
附图2:M2 Exos的体内效应 附图2:M2 Exos的体内效应
附图2:M2 Exos的体内效应