| 53分Nature子刊关于肿瘤免疫治疗最新综述:PD | 您所在的位置:网站首页 › 对不良品进行标识的目的是 › 53分Nature子刊关于肿瘤免疫治疗最新综述:PD |
53分Nature子刊关于肿瘤免疫治疗最新综述:PD
|
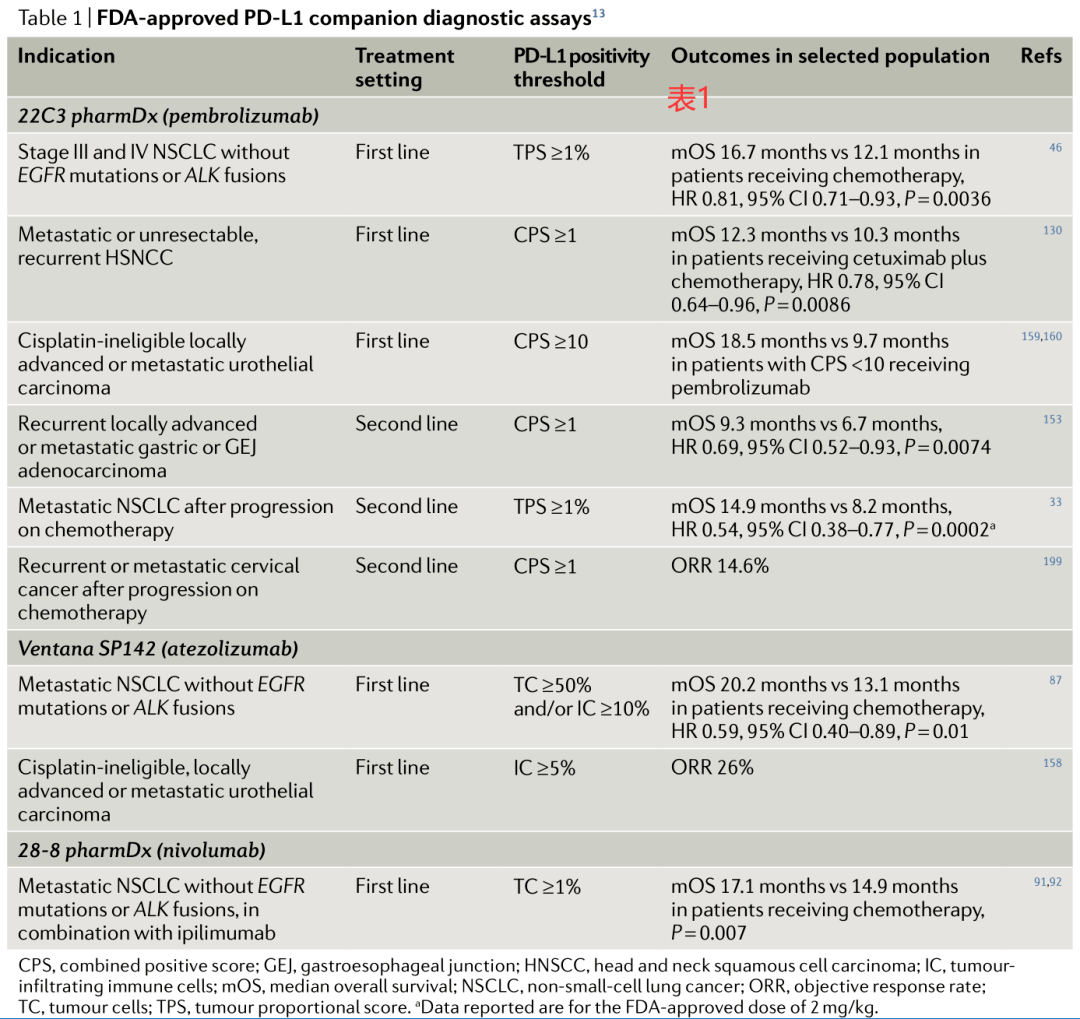
这一观察结果表明,抑制这一免疫检查点可以促进抗肿瘤免疫,从而消除肿瘤细胞,并为进一步将PD-L1的表达发展为抗PD-1(如pembrolizumab、nivolumab和duvalumab)或抗PD-L1(如atezolizumab和avvelumab)抗体应答的预测性生物标志物提供了有力的理论依据。 PD-1或PD-L1抗体改变了许多晚期癌症的治疗格局,包括黑色素瘤、肺癌、乳腺癌、肾癌和许多其他癌症。越来越多的研究报道称,这些疗法(相对于以前的标准治疗方法)取得了良好的长期效果;然而,在大多数情况下,只有20%-40%的患者会有反应,疾病获得长期缓解的患者更少。 因此,开发一种方法以筛选出能从这些药物中受益的患者群体有着非常重要的作用。我们需要更好地理解原发性和获得性耐药的机制,这两种机制很常见,但也都了解得很少。另外,还必须考虑这些药物的毒性风险,以及在可能有其他有效治疗方法的情况下确保患者不被置于无效治疗的处境。 PD-L1的表达可通过免疫组化来(IHC)检测,在肿瘤细胞和免疫细胞上均有发现,但在各种肿瘤类型的患者中,PD-L1表达是一种有用的、但尚不完善的预测抗PD-1或抗PD-L1抗体的生物标志物。在研究nivolumab和atezolizumab的安全性和有效性的最早研究中,证实了PD-L1表达作为预测性生物标志物的潜在效用,为进一步开发PD-L1的表达用于这一用途提供了强有力的理论基础。FDA已经批准了用于评估PD-L1表达的多种检测方法,通常与特定的治疗药物联合使用;并不是所有的检测方法都具有同等的灵敏度和重复性。 此外,使用不同的化验方法对同一样本进行分析可能会导致不一致的结果,这可能会对患者是否合适接受抗PD-1或抗PD-L1抗体产生重要影响。在这篇综述中,我们讨论了通过IHC确定PD-L1表达,作为在各种相关肿瘤类型中对抗PD-1或抗PD-L1抗体应答的预测性生物标记物的目前证据水平,重点放在评估方法、技术挑战、监管环境(the regulatory landscape)和未来有可能提高PD-L1表达作为预测性生物标记物的实用性的研究方向上。 伴随诊断和互补诊断 FDA批准的PD-L1检测分为“伴随性”或“互补性”诊断。FDA将伴随诊断定义为提供“对安全和有效地使用相应药物或生物制品必不可少的信息”的产品。这样的测试有助于医疗保健专业人员确定特定疗法的益处是否可能超过对特定患者任何潜在的严重不良影响或风险,并与特定药物的使用有关。 在欧盟,伴随诊断的定义是“对于安全和有效地使用相应医疗产品至关重要的设备,(A)以在治疗之前和/或治疗期间识别最有可能从相应医疗产品中受益的患者;(B)或在治疗之前和/或治疗期间识别可能因使用相应医疗产品治疗而增加严重不良反应风险的患者”。 FDA已批准使用三种PD-L1 IHC检测作为辅助诊断:DAKO 22C3(后文简称为22C3)用于治疗各种实体肿瘤患者的帕博利珠单抗(pembrolizumab);Ventana SP142(后文简称为SP142)用于尿路上皮癌、三阴性乳腺癌(TNBC)或非小细胞肺癌(NSCLC)患者的阿妥珠单抗(atezolizumab);和DAKO 28-8(后文简称为28-8),用于伊匹单抗(ipilimumab)和纳武单抗(nivolumab)联合治疗非小细胞肺癌(表1)。
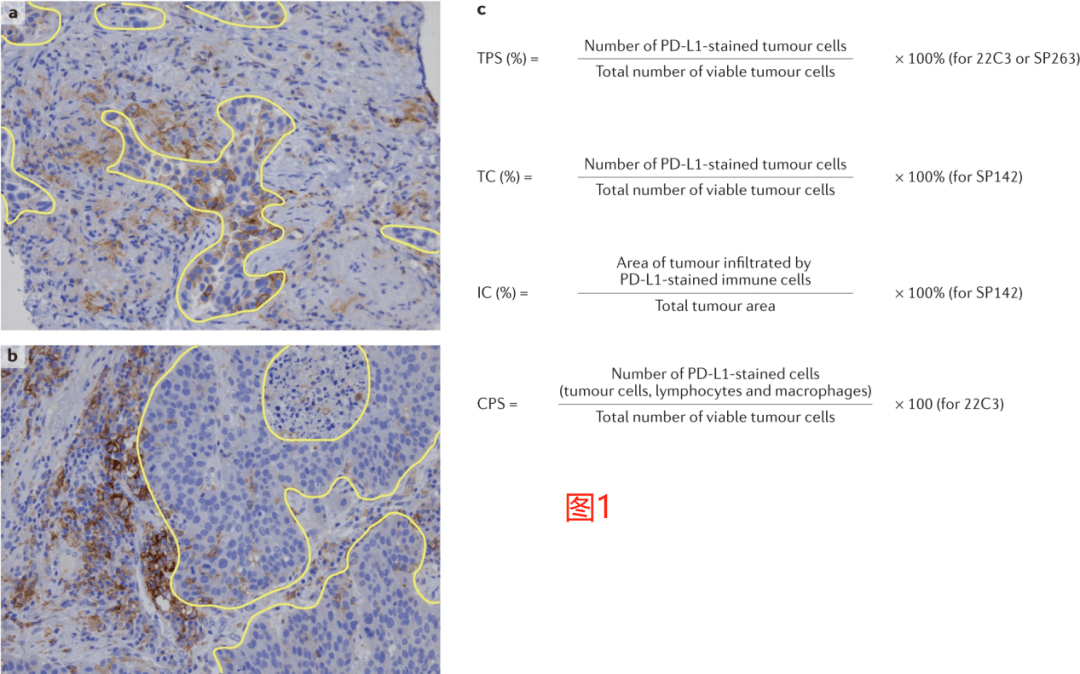
相比之下,目前还缺乏补充诊断的官方定义;然而,FDA的一份草案建议,补充诊断是“它是用于识别生物标记物所确定(defined)的患者子集(subset)的一种测试,这些患者对药物的反应特别好,并有助于个别患者的风险/益处评估,但这些不是接受药物的先决条件”。 在美国,28-8和Ventana SP263(后文简称为SP263)检测被认为是晚期非小细胞肺癌患者使用纳武单抗和晚期尿路上皮癌患者使用duvalumab的互补诊断。这篇文章主要关注FDA已批准的伴随和补充诊断测试,尽管这些批准和要求可能并不是普遍适用的,因为其他地方的监管机构对使用PD-L1作为生物标记物来使用采取了不同的方法。 PD-L1定量在临床实践中的应用 1. 选择需要评估的细胞子集 IHC可以评估PD-L1在肿瘤细胞和肿瘤浸润性免疫细胞上的表达,包括巨噬细胞、树突状细胞、中性粒细胞、髓系来源的抑制细胞以及T细胞和/或B细胞。 在接受纳武单抗或帕博利珠单抗治疗的病人的临床试验中,使用肿瘤比例评分(tumour proportional score,TPS)或肿瘤细胞(TC)的表达在很大程度上检验了PD-L1表达在肿瘤细胞上的预测能力,其定义是具有部分或完全膜性PD-L1染色的可计数(viable)肿瘤细胞相对于样本中所有可计数肿瘤细胞的百分比(图1)。
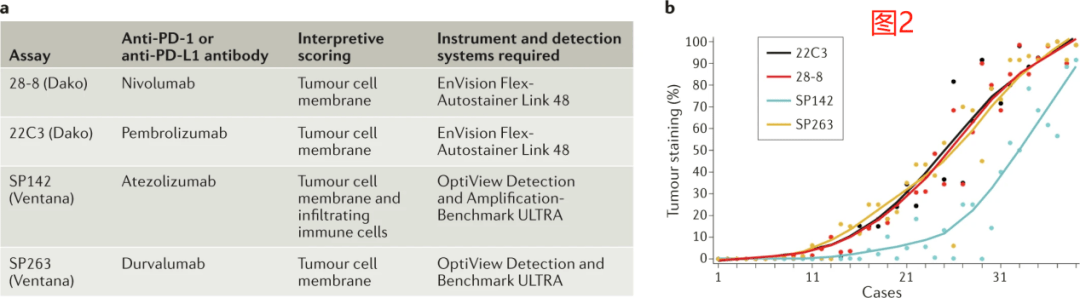
相比之下,在探索阿妥珠单抗疗效的试验中,使用了SP142试验来评估PD-L1在肿瘤细胞和肿瘤浸润性免疫细胞上的表达。评估肿瘤细胞上PD-L1表达的公式与用于计算TPS的公式相同,而免疫细胞上的PD-L1通常被估计为表达PD-L1的免疫细胞浸润的肿瘤面积相对于总肿瘤面积(图1)。 在其他接受免疫检查点抑制剂(ICIs)治疗的研究中,也检测了PD-L1在肿瘤细胞和肿瘤浸润性免疫细胞上表达的预后价值。例如,Keynote-028是一项Ib期研究,在该研究中,接受帕博利珠单抗治疗的晚期实体肿瘤患者,使用22C3检测进行量化后,要求肿瘤或间质细胞有≥1% 可表达PD-L1。 类似地,在一项I/II期研究中,晚期尿路上皮癌患者接受Durvalumab单药治疗,使用SP263检测进行量化,发现那些≥25%的肿瘤或免疫细胞上有PD-L1表达的患者可发生更高的应答率。探索性的生物标志物分析随后采用了这一特定的阈值点(cut-off point)。 随后开发了一种评分算法,称为综合阳性评分(combined positive score,CPS),其定义为所有PD-L1+细胞(肿瘤细胞、淋巴细胞和巨噬细胞)的总和除以可计数的肿瘤细胞总数(图1)。对于TPS和CPS,当使用22C3和28-8检测时,被评估的切片中必须至少存在100个可计数的肿瘤细胞才达到足以进行PD-L1评分的标准,而当使用SP142检测时,必须至少有50个肿瘤细胞是可用于评估的。而到目前为止,仅发表了两项评估病理学家之间CPS可重复性的研究数据。 22C3测试制造商进行的一项研究显示,对胃癌和/或胃食管交界处(GEJ)癌症患者样本的评估总体百分比一致性(overall percentage agreement,OPA)为96.6%。然而,一个独立研究小组的结果表明重复性较差,分别使用22C3和SP263检测法,CPS ≥ 1的组内相关系数分别为0.39和0.26,CPS ≥ 10的组内相关系数分别为0.23和0.14。 这些结果表明,在常规临床应用该系统之前,还需要对执业病理学家的CPS的重复性进行更多的研究和/或对他们作进一步培训,该系统目前仍是PD-L1评估的次优方法。考虑到在Blueprint II期研究中对TC和肿瘤浸润性免疫细胞(IC)评分的独立评估显示TC评分的一致性很高,ICC为0.86-0.93,而IC评分显示观察者间的可重复性较差,ICC为0.18-0.19,因此提高CPS在研究人员间的一致性水平可能个有挑战性的工作。 除了TC和IC评分系统,PD-L1在特定免疫细胞群体中的表达也可能是预测ICI反应的一个潜在生物标志物,这也是一个活跃的研究领域。例如,在NSCLC患者中,CD68+巨噬细胞被确认为肿瘤和间质中表达PD-L1最显著的细胞,巨噬细胞中PD-L1的高表达与NSCLC患者的总生存期(OS)显著延长相关,而肿瘤细胞PD-L1的高表达与此无关。 2. 实践和挑战 随着ICIs试验的开展,肿瘤PD-L1的表达已逐渐演变成了一种选择标准。最初,试验招募了一些与PD-L1状态无关的患者。事后的分析表明PD-L1水平较高的患者的反应有所改善后,部分试验通过限制那些肿瘤细胞PD-L1表达水平很低的患者的入组来提高反应率。 肺癌患者的试验证明了这种基于PD-L1状态进行选择的趋势;在接受帕博利珠单抗治疗晚期非小细胞肺癌患者的I期Keynote-001试验中,PD-L1 TPS为50%的患者的应答率为45.2%,而TPS为1-49%和1%的患者使用帕博利珠单抗的批准速度。 在一项涉及相同患者群体II/III期的后续研究中也得到了证实,即在TPS为≥50%的患者中观察到了治疗效果的进一步改善。FDA还批准Pembrolizumab作为这种情况下的一线治疗方法,此前一项III期研究比较了Pembrolizumab与以铂为基础的化疗治疗效果,结果显示Pembrolizumab在无进展生存期(PFS)和OS方面都有显着改善。 到2016年秋季,根据肿瘤细胞PD-L1的表达水平,Pembrolizumab被FDA批准用于一线和二线治疗。然而,在后期试验中nivolumab和atezolizumab的试验未能表明PD-L1状态和治疗结局之间有足够强的相关性,因而并不能证明使用PD-L1 IHC分析作为必需的(伴随性)诊断是合理的。 这些试验结果的差异,以及人们意识到一部分PD-L1阴性的肿瘤患者可以从ICIs中受益,共同推动了人们对PD-L1作为临床生物标记物的普遍怀疑。在上述2016年FDA批准之后,病理学家开始质疑他们自己是否有能始终如一地做出支持这种生物标记物驱动的方法所需的准确的半定量判断。 尽管染色步骤标准化,并将pembrolizumab配套诊断(22C3)和其他补充诊断分析包装为商业试剂盒,但许多研究表明,做出解释的病理学家之间也存在很大程度的差异。病理学家之间的OPAs会根据定义的截断点而不同,TPS为1%时,OPAs从76%到84%不等,TPS为50%时,OPAs从76%到82%到>94%不等。 在一项比较6个病理学家和5个商业PD-L1检测结果的研究中,在0-20%的样本(TPS为1%)和0-5%的样本(TPS为50%)中,个别病理学家的得分偏离了共识。在另一项研究中,比较了10位病理学家使用22C3分析解释非小细胞肺癌样本的表现,在1%和50%的分界点上,观察者内部的OPA均为90%。 公认的协议措施是有争议的。90%的检测间一致性是美国病理学家学会进行IHC测定验证的拟定基准,临床试验中生物标记物的开发可能需要观察者间(interobserver)的至少有0.6或0.8(Cohen's Kappa)一致性。 尽管有这一建议的、可接受的一致性水平,病理学家在TPS为1%且多达25%的样本中对PD-L1 TPS评分持不同意见的临床意义尚不清楚。这一点不应该被解释为对病理学家能力的谴责,而是应该提醒人们对于人类感知的极限,和对那些位于复杂视觉环境中的生物标记物进行精确定量测量的能力极限。 事实上,22C3检测在市场上销售时被明确作为定性检测,尽管制造商根据临床适应症提供了对肿瘤细胞和免疫细胞表达进行相对定量的指南。 FDA最终批准帕博利珠单抗用于转移性非小细胞肺癌患者和PD-L1TPS≥1%的患者,尽管PD-L1表达水平较低的患者,其存活率仍相对较低。相比之下,EMA拒绝在这种情况下批准pembrolizumab,因为在PD-L1评分为1-49%的患者中,帕博利珠单抗缺乏相对于化疗的明确优势。 虽然不是为了批评EMA的决定,但FDA的批准使临床医生能够决定PD-L1表达水平处于低到中等水平的患者的治疗过程,因为他们现在可以选择单独接受ICI或ICI加化疗。这种方法也促使病理学家提供一个定量的而不是分类的(高或低)PD-L1评分,因为PD-L1的表达是一个连续变量,而且TPS为1%相对于TPS为40%似乎有着不同预测意义,即使这两个评分都被归类为“弱阳性”。 许多病理评分系统认识到病理学家无法基于视觉评估来提供精确的定量测量,因此强调半定量的方法,将其分为5%或10%的增量。 目前对PD-L1评分的最佳报告实践缺乏明确的指导;然而,在我们看来,以5%或10%的增量来报告TPS的方法向临床医生提供的报告可能是最合适的,同时避免像‘TPS=46%’这样人为精确度的评分。 TPS>90%的NSCLC患者的客观有效率(ORRS)、中位PFS和中位OS都明显好于TPS为50-89%的患者。这些数据结果还没有被广泛推广,尽管如果不以半定量的方式来记录TPS评分,那么研究‘PD-L1+’癌症患者的不同治疗反应将会是不可能的。 最后,更精确、更定量的PD-L1评分方法,无论是对肿瘤细胞还是免疫细胞,都可能受益于数字病理学和自动图像分析。这样的方法必然需要重大的基础设施升级,至少需要广泛的分析和技术验证,以建立起与病理学家评估结果之间的一致性。 对新辅助治疗前后样本免疫微环境中PD-L1表达的探索性分析已经证明了多重(multiplexed)成像和自动化分析的可行性;然而,还需要对所有相关治疗设置进行前瞻性的临床验证。 3. 检测间(Inter-assay)异质性 在开发抗PD-1和抗PD-L1抗体的过程中,每个制药公司都在追求开发自己独特的诊断抗体和相应的PD-L1染色和解释方案。这种脱节的方法在将PD-L1发展为跨不同肿瘤类型的通用预测生物标记物时成了一项重大挑战。 为了阐明最常见的诊断性PD-L1检测之间分析的异同,我们进行了蓝图PD-L1 IHC检测比较项目(图2,3)。这项比较性的分析研究表明,28-8(BMS;nivolumab)、22C3(默克;帕博利珠单抗)和SP263(阿斯利康;durvalumab)检测在基于TPS且不考虑强度的肿瘤细胞染色方面具有类似水平的表现,而SP142(基因泰克/罗氏;atezolizumab)检测灵敏度较低。 这项研究还显示免疫细胞染色比肿瘤细胞具有更大的测定间变异性。这些发现与一项前瞻性的多机构NCCN研究一致,该研究比较了22C3、28-8、SP142和CellSignaling 的E1L3N检测的性能,并发现SP142的灵敏度低于其他三种检测方法。这项研究还证实了病理学家对肿瘤细胞评估的一致性水平,但在免疫细胞的PD-L1表达方面却没有。
在随后的第二阶段蓝图研究中,Dako 73-10检测(辉瑞/默克血清;Avelumab,后来称为73-10)被添加到被分析的检测组中,并被发现相对于其他检测方法, 73-10在肿瘤细胞染色方面具有更高的灵敏度。 在2020年4月发表的一项研究中,73-10的性能与22C3的性能进行了比较,发现在22C3的≥50%的PD-L1表达和73-10在≥80%的阈值下相似。因此,对于PD-L1表达值不满足这些阈值的样本,两种检测方法就不具有可比性。 尽管做出了不少努力来评估现有检测方法的分析特性以及操作者间的可变异性程度,但目前还缺乏在不同检测方法之间以及不同抗PD-1或抗PD-L1抗体之间的治疗结果的临床比较,尽管这些检测方法显然不是通用的、可互换的。正在进行的回顾性研究就是比较基于SP142或22C3分析选择接受阿妥珠单抗治疗的患者的临床结果。 不同PD-L1 IHC平台的独特要求是使用限定的自动染色机。例如,22C3化验需要使用自动染色器Link48,而当这种化验方法首次出现时,病理实验室还并没有广泛使用这种化验方法。 因此,许多实验室使用其他染色平台,如实验室开发试验(LDT)。在2019年8月发表的一项分析中,将LDTs 的性能与AutoStaner Link 48的性能进行了比较,得出的结论是:协调是可能的;尽管如此,依然缺乏比较临床结果的相关数据。 同样,由同一研究小组对不同PD-L1检测性能所进行的大型meta分析得出结论,当检测实验室不能将FDA批准的评估PD-L1的伴随诊断用于其特定临床目的时,为相同目的使用适当验证的LDT比用FDA所批准的另一种针对不同目的开发的伴随诊断更有效。 总之,这些研究表明,三种PD-L1检测方案(28-8、22C3和SP263)具有相似的分析性能,可以互换使用。Blueprint第二阶段研究还显示,在20多名受过专业培训的国际公认病理学家中,28-2、22C3、73-10和SP263在所有表达水平的肿瘤细胞染色的解释中具有很高的重复性,在1%的分界点上的一致性则略低。 然而,PD-L1在免疫细胞上的重复性明显低于在肿瘤细胞上的重复性。此外,还需要对LDTs 与FDA定义的方案进行进一步的临床比较研究。 4. 样本考虑 在实践中,用于诊断和生物标记物测试的肿瘤活检取样是由病变大小、易获取程度及其能提供临床分期信息的可能性来共同驱动的。对于许多患者来说,即使是在多发转移的情况下,也只会采样一个病灶。 活检取样的方法也各不相同,包括手术切除、转移瘤切除、芯针活检取样和细针抽吸。一般来说,检测ICIs的临床试验并不强制使用从原发灶和转移灶获得的活检样本。因此,大多数与这些试验相关的生物标记物研究必然包含样本位置和类型的异质混合。 然而,当临床医生确实可以获得多个不同的活检样本时,他们应该如何选择最佳样本进行生物标记物测试则仍然不清楚。最优样本的定义仍然是一个重要的问题:它是最具代表性的样本,还是最有可能产生阳性PD-L1结果的样本?尽管有一些经验数据可以指导这一决定,但这些问题大多仍未得到解决。 4.1 样本年龄 较老的样本似乎不是评估PD-L1的可靠材料来源。在ATLANTIC试验中,曾接受药物治疗的晚期非小细胞肺癌患者接受了Durvalumab治疗后,3年以上的样本PD-L1阳性率明显降低,其中PD-L1采用SP263量化,肿瘤评分>25%将被定义为阳性。在一项使用PD-L1研究抗体9A11的单中心研究中也观察到了类似的结果。此外,较老的样本可能不再能准确地反映出患者肿瘤的免疫学状态,从而不能准确反映他们从ICIs中受益的可能性。 4.2 原发样本和转移样本 对非小细胞肺癌和尿路上皮癌患者原发灶和转移灶的标本进行PD-L1免疫组化检测,结果显示一致性为75-88%,尽管这类研究经常受到采样间的时间和治疗间隔的干扰。 例如,在NSCLC患者中,来自原发肿瘤和脑转移病灶的配对样本的肿瘤(但不是免疫细胞)PD-L1的表达存在正相关。然而,在另一项研究里,采用PD-L1表达最小阈值点采用5%时,有14%的配对样本被发现在肿瘤细胞的PD-L1表达不一致,这些样本获取之间的中位间隔为11个月。 据报道,有22%的NSCLC患者尽管在同一时间点进行了切除,并且没有进行新辅助治疗,PD-L1的表达在原发肿瘤和纵隔淋巴结转移灶之间仍然存在差异。在本研究中,PD-L1的状态在相同频率的位点之间从正(定义为H-Score>1)转变为负(反之亦然)。 相比之下,乳腺癌患者转移瘤中肿瘤浸润淋巴细胞的数量和PD-L1的表达(肿瘤或免疫细胞上的)均明显低于原发肿瘤样本。在对来自非小细胞肺癌患者的大量未配对样本的分析中,肝和肾上腺转移瘤的PD-L1表达水平往往高于脑和骨转移瘤。 4.3 时间点 对不同时间点获得的配对样本所进行的几项分析提供了一致的结果(从67-74%的样本),尽管导致这种差异表达的临床因素充其量是部分确定的。PD-L1的表达在接受ICI或其他治疗后可能会改变,这取决于所接受的特定治疗和原发肿瘤组织学特征。经ICI或新辅助化疗后,NSCLC肿瘤细胞上PD-L1表达降低。据报道,化疗不会影响尿路上皮癌中PD-L1的表达,但这方面的研究有限。 4.4 样本类型 在非小细胞肺癌、头颈部鳞状细胞癌(HNSCC)和尿路上皮癌肿瘤标本的连续切片中,肿瘤细胞上PD-L1的表达似乎高度一致。然而,瘤内异质性是一个公认的挑战,它可能会搅乱小样本中PD-L1表达的测定。在非小细胞肺癌(NSCLC)标本中,PD-L1表达的异质性在某些情况下可归因于侵袭性的程度,表现为在肺腺癌标本中,PD-L1在胚层(lepidic)生长成分中相对缺乏表达,而在肉瘤样成分中相对高表达。 在许多情况下,PD-L1表达的显著位置差异不能仅仅通过形态学上的差异来解释;亚克隆基因组、转录或表观基因组进化都可以促进免疫逃逸,也可能解释PD-L1表达在肿瘤内的差异。鳞状非小细胞肺癌的PD-L1表达水平通常比腺癌更为均匀,尽管文献中的报道各不相同。 一项使用SP142检测PD-L1 TC和IC评分的研究发现,来自诊断活检样本和非小细胞肺癌患者明确切除样本的配对材料之间有48%的不一致,其中75%的差异是由IC评分的差异造成的。 细胞学样本通常不用于临床试验,尽管此类样本在临床实践中经常被广泛用于诊断和生物标记物测试,并且在使用PD-L1 TPS进行评估时与手术标本高度一致,但它们不能稳定地产生IC评分。 无论样本类型如何,适当性要求每个样本至少有100个肿瘤细胞,用于22C3和28-8检测的PD-L1染色,以及至少50个肿瘤细胞用于SP142。这些数字不一定是由临床结果驱动的,尽管研究表明,当至少一个样本含有10既没有经过验证,也没有进行独立评估。也许最大的希望是,更新、更客观、更标准化的化验方法最终将取代这些非标准化化验方法。 5. 头颈部鳞状细胞癌 2016年,FDA批准pembrolizumab或nivolumab作为单一疗法,用于在一线铂类化疗后病情进展时复发和/或转移性且PD-L1状态未知的HNSCC患者。Pembrolizumab的加速批准是基于多中心Keynote-040随机III期试验的完成,该试验证明了pembrolizumab优于SOC疗法。 Keynote-040和Checkmate 141都证明了pembrolizumab和nivolumab在OS方面都提供了类似的益处,并评估了与SOC化疗相比的1年存活率。在Keynote-040中,使用了22C3检测,pembrolizumab的受益与PD-L1 CPs ≥1相关,而对于CPS值 |
【本文地址】