| H3o+ Lewis 结构、特性:43 项完整速览 | 您所在的位置:网站首页 › 如何画路易斯结构式 › H3o+ Lewis 结构、特性:43 项完整速览 |
H3o+ Lewis 结构、特性:43 项完整速览
|
本文主要研究了h3o+ lewis结构以及与h3o+ lewis结构相关的基本性质。 这将说明有关 h3o+ 刘易斯结构的一些关键事实。 h3o+ 路易斯结构是一种重要的离子,通常称为水合氢离子,由水通过质子化形成。 它是一种正离子,总是由阿伦尼乌斯酸在化学反应中产生,在反应中以溶液形式损失质子。 H+ 离子和共轭碱是由水溶液中的 H3O+ Lewis 结构产生的。 一般来说,所有的三价氧阳离子都统称为氧鎓离子,因此水合氢离子的另一个名称是氧鎓离子。 如何画出 H3o+ 刘易斯结构?h3o+ 路易斯结构在化学中很重要,我们将在酸碱化学和通常认为的酸中研究它。 原子中自由电子和键合电子对的总数也由路易斯结构表示。 刘易斯结构不考虑分子的内壳,仅考虑价壳电子。 h3o+ lewis 结构由以下步骤绘制: 步骤:1 在 H3O+ 中找到价电子对于关于元素周期表的 h3o+ lewis 结构研究,我们将从元素周期表中计算水合氢离子中存在的价电子。 因此在 H3O+, 总共存在 8 个价电子。 步骤:2 找到电负性原子在计算完价电子后,我们必须找到存在于中心的电负性元素。 刘易斯点结构。 在 H3o+ 的情况下,由于电负性更强的原子,氧位于中心原子,而氢位于外部原子。 步骤:3 分配每个原子周围的价电子知道电负性原子和价电子后,就可以将电子分布在中心原子周围。 两个电子被放置在它周围并在它周围形成化学键。 步骤:4 填充每个原子的八位字节在分配了中心原子周围的价电子后,原子的外部八位字节就完成了。 步骤:5 将剩余的价电子分配给中心原子在没有八位字节的原子中创建双键或三键需要电子在外部原子和中心原子之间移动。 我们在 H 3 O + 中失去了一个价电子,如 + 符号所示 路易斯结构。 因此,H3O+ Lewis 结构 只有8个价电子。 H3o+路易斯结构共振来自 刘易斯结构 的H3O+ 我们可以看到它与氨分子是等电子的,因为两个分子的中心原子都是带负电的,例如 O+ 和 N 具有相同的电子数。 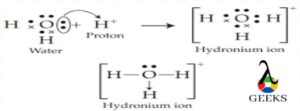 路易斯结构 路易斯结构H3O+ 分子具有对称结构和角为 113 度的三角锥体几何形状。 H3o+ 路易斯结构形状原子在分子几何学中以三个维度排列,分子几何学可以用来确定分子的物理和化学特性。 H3O+ 离子的形状像一个三角金字塔。 在水合氢离子的中心氧原子上,有三个OH键和一对不成对电子。 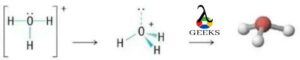 刘易斯结构形状 刘易斯结构形状结果,在主要氧原子周围形成了四个电子密度区域。 由于中心氧原子周围的电荷分布不均匀,水合氢离子的形状为三角锥体。 H3O+ 刘易斯结构呈金字塔形,三个氢原子位于氧的角落并形成一个三角形。 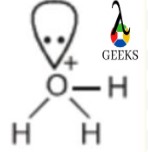 三棱锥形状 三棱锥形状因此,H3O+ 由于氧原子上存在一对孤对电子,显示出三角锥体分子几何形状和锥体形状。 H3o+ lewis 结构具有四面体的电子几何结构。 H3o+ 路易斯结构正式充电分子上的形式电荷可以通过以下公式计算, 形式电荷= 自由原子由价电子组成 - (非共享电子的数量 - 原子周围的 ½ 共享电子)。 H 3 O + 分子由三个键和一个带+1形式电荷的孤对组成。 氢属于元素周期表中的第 1 族,有一个价电子,类似地,氧属于元素周期表中的第 14 族,由六个价电子组成。 3H 上的 FC = VE- NE- ½(BE) = 1 – 0 – ½ (2) = 0 O 上的 FC = 6 – 2 – ½ (6) = +1 从而 H3O+ 正式收费是 + 1。 我们知道给定分子的路易斯结构越稳定,其正式电荷值必须越低。 H3O+ 离子最稳定的路易斯点结构是因为水合氢离子只有一个 +1 正式收费,最低的一个。 H3o+ 路易斯结构角中心原子与键合原子形成的角度称为键角。 由于围绕中心原子的电子密度区域的吸引力,分子之间的键角不同。 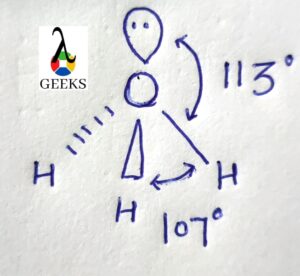 H3O+ 键角 H3O+ 键角H3O+ 离子与四个高电子密度区域的键角为 113 度。 H3O+ 的中心原子是氧,它形成了三个 OH 键和一对孤对电子。 因此,H3O+ 离子的几何形状是三角锥体,具有 113度键角 形成。 H3o+ 刘易斯结构八位组规则八位组规则描述了原子通过失去、获得或共享电子而在其价层上拥有 8 个电子的自然趋势或愿望。 原子通过获得、失去或共享电子来呈现最近的惰性气体的电子结构。 除氢和氦外,所有元素都遵循八位组规则。 双峰规则适用于氢气和氦气等气体。 在 H3o+(水合氢离子)的情况下,氧原子带有八位字节,三个氢原子带有双胞胎。 H3o+ lewis 结构孤对氧原子具有一对孤对和三个将其与氢原子连接的单键,形成路易斯结构 H3O+。 氧原子带有正电荷,因为它在 H3O+ 的路易斯结构中显示的电子较少。 因此,氢离子的路易斯结构仅包含一对电子。 H3o+ 价电子术语“价电子”是指存在于原子最外层的电子总数。 在任何化学键的形成中,只涉及价电子。 对于这种债券的形成,它们必须要么重新分配,要么全部或部分共享。 氧的最外层有六个电子,氢的最外层有一个电子。 因此,水合氢离子中的总价电子为 8(6+1*3-1),因为它们带有正电荷。 H3o+杂交到,杂化过程结合原子轨道以创建新的杂化轨道,用于在化学键中配对电子。 由于其三个 OH σ 键和一对孤对电子,水合氢离子 (H3O+) 表现出 sp3 杂化。 空间数也可用于计算杂交。 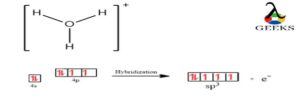 Sp3 杂交 Sp3 杂交位阻数=与中心原子键合的原子数+该原子中孤电子对的数量。 在 H3O+ 离子中,因此水合氢离子中的空间数 = 3 + 1= 4(sp3) sp3 杂交的存在由 4 表示。 H3o+ 溶解度根据 Arrhenius 的酸概念,酸是一种在溶解时会释放质子或 H+ 的化合物。 现在阿伦尼乌斯酸已经释放出 H+,质子与水分子相互作用形成水合氢离子或 H3O+ 离子。 纯水和酸的溶液会增加氢离子浓度。 氢氧根离子浓度必须下降,[H3O+] [OH-] 才能保持恒定。 因此,溶液被称为酸性溶液,因为 [H3O+] > [OH-]。 如果将碱添加到纯水中,则相反。 h3o溶于水吗是的,它会产生 oH– 和 H3o+ 离子在水中,易溶于水。 为什么H3O+溶于水?水合氢离子被归类为由特定分子中的三个离子组成的氧鎓离子或氧鎓离子的类型。 因此,水合氢离子的产生是由水分子产生的,水作为碱,水合氢离子作为共轭酸。 H3O+如何溶于水?H+ 当酸和水结合时,溶液中会产生离子。 水合氢离子 (H3O+),当这些离子与水分子结合时形成,不能单独存在。 H++ H2O→H3O+ H3o+ 是电解质吗?如果 H3O+ 是更强的酸,该溶液的导电性会非常差或根本不导电。 为什么 H3O+ 是电解质?它对带相反电荷的离子的吸引力非常强大,以至于氢离子 (H+) 与水分子结合形成水合氢离子 (H3O+),表明水中没有游离氢。 H3O+如何成为电解质?当 H3O 获得 H+ 时,它会形成 H2O+,因为它们很容易提供 H+,所以强酸是强电解质的好例子,因为它们在水中几乎完全解离。 强酸 HCl 在水中解离,将 H+ 转化为 H2O。 1 摩尔强酸在水中解离产生 1 摩尔氢离子和 1 摩尔其共轭碱。 所得溶液基本上只含有 H3O+(一种强电解质)和 Cl-。 H3o+ 是酸性还是碱性?H3O+ 的路易斯结构中有 3 个价电子。 正如路易斯结构中的 + 符号所示,我们在 H3O+ 中失去了一个价电子。 因此,H8O+ Lewis 结构只有 3 个价电子。 HXNUMXO+,被归类为酸。 为什么 H3O+ 是酸性的?在这种情况下,水合氢离子 (H3O+) 是指定的路易斯酸,它仅作为与路易斯碱相互作用的质子来源。 H3O+ 是如何酸性的?H+攻击水溶剂形成水合氢H3O,实际上:H+ + H2O 产生 H3O+、H+ 质子和 H3O+ 水合氢离子(H+ (aq) 和 H3O+ (aq))被认为是相同的。 这些术语可以互换使用。 H3o+ 是强酸吗?稀水溶液仅含有 H3O+ 作为最强酸。 为什么H3O+是强酸?水变成 H3O+,一种酸,当它作为碱时,它被称为水的共轭酸。 酸是解离产生 H3O+ 离子的物质。 H3O+ 应该是可用的最强酸,因为它甚至不需要解离即可发挥作用。 在水的存在下,水合氢离子变为酸性。 当水分子相互作用形成 H3O+ 时,就会发生这种情况,HXNUMXO+ 在化学反应中充当碱并且是水的共轭酸。 H3O+强酸怎么样?当水作为碱时,水合氢离子变成酸,在水分子的反应过程中会产生 H3O+,它是水的共轭酸,在某些化学反应中充当碱。 h3o+ 是 arrhenius 酸吗?在水溶液中,阿伦尼乌斯酸是一种电离产生氢离子 (H+) 的物质。 酸是含有可电离氢原子的化学物质。 电离性仅适用于作为高极性共价键一部分的氢原子。 为什么 h3o+ 是阿伦尼乌斯酸?因此,在水中分解产生 H+ 离子的材料被定义为水。 它还符合在水中分离成 OH- 离子的物质的标准。 这是唯一的阿伦尼乌斯两性化学物质,因为它既是阿伦尼乌斯酸又是碱。 h3o+ arrhenius 酸怎么样?酸是提高水溶液中 H+ 或质子浓度的物质,为了产生非自由漂浮质子的水合氢离子 (H3O+),释放的质子或 H+ 离子与水共存分子。 H3o+ 是极性的还是非极性的?H3O+ 是一种极性分子,因为它顶部有两个孤对电子,这会导致电子-电子排斥。 为什么 H3o+ 是极性的还是非极性的?羟基离子的电负性为 3.44,而水合氢离子的电负性为 2.20。 因此,电负性差为 1.24。 0.4% 到 1.7% 的电负性差异落在这个范围内。 因此,OH键中将存在极性共价键。 H3o+ 是极性的还是非极性的?决定其极性的是分子的偶极矩。 通过将电荷幅度除以正负电荷中心之间的距离来计算偶极矩。 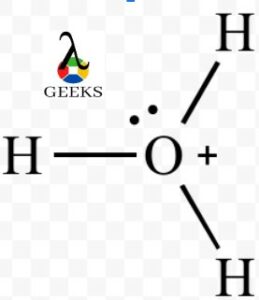 H3O+ 极性 H3O+ 极性当中心原子周围的原子不对称排列时,就会产生偶极矩。 在氧气周围,有四个不对称区域,它们产生净偶极矩并使水合氢离子极性。 H3o+ 是路易斯酸吗?根据 H3O+ 的 Lewis 结构,+ 符号代表一个已丢失的价电子。 酸碱化学在很大程度上取决于路易斯结构。 因此,H3O+ 在化学中起路易斯酸的作用。 为什么 H3O+ 是路易斯酸?H2O的共轭酸是H3O+。 在水溶液中,质子用符号 H3O+ 表示。 H3O+ 是一种路易斯酸吗?在非水溶液中会形成不同的质子结构。 这表明 H2O 是两性的(可以是酸或碱)并且具有由 H+ 和 OH- 离子 (OH-) 的等量混合物组成的去质子化形式 (H3O+ 或 OH-)。 这将导致在水溶液中形成强酸。 H3o+ 是线性的吗?不,H3O+ 不是线性的,由于 O 与三个氢原子相连并具有孤对电子,因此 H3O+ 分子具有四电子密度,因此该分子是四面体。 形状将是三角锥体,因为只有一对孤立的. 为什么 H3o+ 是线性的?构成氧的三个氢原子在其三个角处排列成三角形,氧的一对孤对电子使 H3O+ 的金字塔形状是孤对。 H3o+ 是如何线性的?由于 H3O+ Lewis 结构总共包含 8 个价电子,氧由三个与氢的键和一个孤对电子组成。 这导致氧的中心原子被四个电子密度区域包围,使水合氢离子具有四面体结构,尽管它们呈三角锥体形状。 H3o+ 是顺磁性的还是抗磁性的?是的,H3o+ 是一种具有正号的顺磁性离子,其中存在未配对电子并充当路易斯酸。 H3o+ 沸点水合氢离子没有沸点和熔点,因为它以离子形式存在于水溶液中,以H3O+和OH-形式存在。 所以水有沸点,水合氢也有同样的沸点。 H3o+ 键角根据 VSEPR 理论,它表现出 sp3 杂化,键角为 109.5 度。 然而,精确的键角为 113 度,因为存在正电荷和孤对电子。 三个其他原子和一对电子围绕着 H3O+ Lewis 结构的中心氧 (O) 原子。 h3o+ 是两性的吗?当一个物种既可以作为碱也可以作为酸时,它被称为两性,因此,它必须具有在需要时接受和提供质子的能力。 例如,我们知道水是两性的。 水的质子化形式是 H3O+,因此它也可以表现为强酸。 所以,答案是否定的,水合氢离子不是两性的。 为什么 h3o+ 不是两性的?由于水的两性性质,H2O 可以通过充当质子供体或受体并形成 H3O+ 和 OH- 来充当碱。 因此,水在酸性介质中充当碱并在溶液中产生共轭酸。 h3o+ 怎么不是两性的?在碱的存在下,可以给它一个质子以形成氢氧根离子,或者可以从酸中接受一个质子以形成水合氢离子 (H3O+)。 自动电离过程从液态水中产生 OH 离子和 H3O+ 离子. 这不是两性的,因为它会导致形成酸性离子。 h3o+ 是 bronsted 碱基吗?不,H3O+ 在水溶液中是布朗斯台德酸,因此它会损失 H+ 离子并产生水分子。 要被称为“强”共轭酸,碱的共轭酸必须比 H3O+ 失去更多的质子。 为什么 h3o+ 不是布朗斯台德碱基?当 Arrhenius 酸(一种在水中解离形成氢离子的物质,例如 HCl)溶解在水中时,当水和酸结合时会产生 H3O+。 因此发生了布朗斯台德洛瑞酸的形成。 h3o+ 是配位键吗?是的,H3O+ 在形成路易斯结构时确实产生了配位键。 在 H3O+ 的形成过程中,一对 O 原子孤对被提供给 H+ 离子的开放 1s 轨道,形成 OH 共价键。 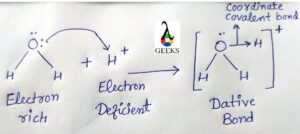 H3O+ 配位键 H3O+ 配位键因此,H3O+ 离子中有两个 OH 共价键和一个 OH 配位键。 形成后,两个 OH 共价键和 OH 配位键是相同的,并且该离子中存在配位键。 为什么 h3o+ 会形成配位键?Arrhenius 酸溶液中的正离子称为水合氢离子。 它由水和氢离子组成。 OH由两个极性共价键和一个配位共价键组成。 当 H+ 和 H2O 结合形成水合氢离子 H3O+ 时,该键称为配位共价键。 对于键合电子,氧提供了它所有的价电子。 h3o+ 是缓冲区吗?不,H3O+ 路易斯结构在缓冲液中的共轭碱中不作为缓冲溶液消耗水合氢离子,当将强酸 (H3O+) 添加到缓冲溶液中时,将其转化为水和共轭碱的弱酸. 结果,存在更多的弱酸和更少的共轭碱。 h3o是氢键吗水合氢离子 (H3O+) 不能形成氢键。 存在称为氢键的分子间力。 在单个 H3O+ 离子内(氧原子和 3 个氢原子之间)存在三个极性共价键。 为什么 h3o+ 会形成氢键?氢键作用在分子之间。 在 H3O+ 的单个离子内,氧原子和每个氢原子之间将存在三个共价但极性键。 正电荷将覆盖整个离子。 h3o+ 是如何形成氢键的?氢键可以通过三个氢中的任何一个连接附近水分子上的氧而产生。 这两个带正电的离子不太可能接近并与其他水合氢离子 (H3O+) 形成氢键,即使它们会相互排斥。 h3o+ 是共轭碱基吗?水在与碱反应时充当酸,释放质子以产生其共轭碱 OH。 因此,OH是水的共轭碱。 碱基是 Bronsted-Lowry 概念中的质子受体。 它获得羟基离子并像碱一样形成共轭酸 H3O+,这类似于它与酸反应时的作用。 因此,H3O+ 是一种共轭酸。 h3o+ 是否大于 oh-?是的,存在于与 ph 值相关的水溶液中的 H3O+ 大于该溶液中的 ho-。 酸性和碱性溶液分别含有 H3O+ 和 OH-。 酸性溶液中存在更多的 H3O+。 酸性溶液中水合氢离子 (H3O+) 的数量大于氢氧根离子 (OH-) 的数量。 如果两种浓度相等,混合物将是中性的。 如果 [H3O+] 小于 [OH-],答案将很简单。 为什么 h3O+ 大于 Oh-?在 25 °C 的中性水溶液中,H3O+= OH-。 水合氢离子 (H3O+) 在酸性溶液中总是大于羟基离子 (OH-),例如醋(水中的乙酸)。 如果溶液是碱性的,例如水中的氢氧化钠 (NaOH),则相反。 我们可能会发现很难理解酸度会随着 pH 值的降低而增加,反之亦然,因为 pH = -log[H3O+]. h3O+ 怎么比 Oh- 大?我们知道水溶液中存在以下平衡:2H2O(l)⇋H3O+ +HO,即所谓的“自质子分解”或水的自电离。 此外,HO- 代表基本原理,而 H3O+ 代表酸原理。 此外,在正常情况下, Kw=[H3O+][HO-]=10 - 14 Kw=[H3O+][HO-]=10 - 14 所以在一个 中性溶液, [H3O+]=[HO-] 但在 酸性溶液, [H3O+]>[HO-]。 根据标准条件, pH=-log10[H3O+],pOH=-log10[HO-]。 而在标准条件下, 酸碱度+酸碱度=14 是 h3o+ 偶极矩吗?H3O+ 分子中氧原子上的孤对电子也有助于解释极性。 H3O+ 是极性分子,因为净偶极子具有非零值。 为什么 h3O+ 显示偶极矩?由于分子顶部存在两个孤对电子,导致电子-电子排斥,H3O+ 是极性分子。 结果,该结构是弯曲的或三角锥体,这导致分子内的电荷分布不均匀。 h3O+ 如何显示偶极矩?根据价壳电子对排斥理论(VSEPR 理论),原子上的电子云和 O 原子周围的单对电子将相互排斥。 因此,它们将被迫分开,使 H3O+ 分子具有三角锥体形状。 此外,该分子中的氧带有正电荷,使其成为具有固有极性的阳离子。 h3o+ 是还原剂吗?不,水合氢离子充当氧化剂,因为它吸收电子并产生氧化还原反应。 h3o+是氧化剂吗氧化剂的其他名称包括氧化剂和氧化剂。 考虑氧化剂的另一种方式是将电负性原子(尤其是氧)转移到基材上的物质。 氧化剂是从其他反应物中窃取电子并使溶液呈酸性的试剂。 与 1 M HCl 反应的所有金属,其中 H3O+ 离子是活性的 氧化剂 在溶液中产生金属离子。 H3o+ 是亲电体或亲核体H3O+(Hydronium)在价壳层中没有空轨道,使其无法获得电子。 然而,H3O+ 继续充当亲电试剂,因为它分解成 H2O 和 H+。 H+ 充当亲电试剂,因为它能够获得电子对。 为什么 H3O+ 表现为亲电试剂?H3O+ 有一对电子,但因为它也带有正电荷,所以它无法捐赠那对电子。 因此,它没有亲核作用。 H3O+ 作为亲电试剂的行为如何?H3O 不是亲电子试剂,因为它有一对孤电子可用于捐赠,这表明它不是缺电子的。 由于 O 的 2p 轨道中存在电子,我预计 H3O+ 将是亲核试剂。 由于其价壳中缺乏开放轨道,H3O+ 无法获得电子。 当 H3O+ 解离成 H2O 和 H+ 时,H+ 可以获得电子对,从而充当亲电子试剂。 h3o+是电解质吗?当强电解质电离(分解)时,H+ 离子总是在溶液中形成。 只有一种最强的酸 H3O+ 可以在稀水溶液中以高浓度存在。 当 [H3O+] 变化时,[OH-] 向相反方向变化,反之亦然。 较低的 [OH-] 和较高的 [H3O+] 较低的 [H3O+] 和较高的 [OH-] [H3O+] = 1•10-7 M 纯水。 h3o+ 是自由基吗?是的,自由基 H3O+ 很容易分解成水分子和氢原子,并且仅在气相中动力学稳定。 为什么 H3O+ 表现为自由基?当 H3O 被单个水分子溶剂化时,它的大部分自由基特性得以保持; 然而,两个水分子将大部分自旋密度转移到溶剂中。 H3O+ 如何表现得像自由基?由于它仅在动力学上是稳定的,并且在气相中很容易分解成水分子和氢原子,因此自由基 H3O 在其氢端具有局部自旋密度。 h3o+水解吗?水解反应是由添加水或提供羟基离子 (OH) 的碱引起的化学键断裂。 在化学键断裂后,水分子的羟基 (OH) 或氢 (H) 会形成两个新键。 水解是离子与水反应生成 H3O+ 或 OH- 的过程。 h3o+ 是单原子的还是多原子的?具有两个以上原子和两个以上电荷(阳离子为正,阴离子为负)的多原子离子由两个以上的原子组成。 在命名任何物种时,总是首先提到正离子或阳离子。 酸将氢离子释放到水中,氢离子结合形成多原子离子 H3O+,这就是酸和 H3O+ 离子相关的原因。 为什么 H3O+ 是多原子的?两个以上带正电荷或负电荷的原子组成一个多原子离子。 一种由三个氢原子和一个氧原子组成的 H3O+ 多原子离子已呈现给我们。 H3O+ 是多原子的吗?每当酸溶解在水中时就会产生这种离子。 酸释放出氢离子,氢离子与水分子结合形成 H3O+。 它是这样的:HCl(aq)+H2OH3O+(aq)+Cl(aq) 由于水基氧化氢与酸释放的氢质子化,因此氧化物离子获得名称oxonium,与氢的H3O + 离子称为水合氢离子。 因此,H3O+ 离子也称为水合氢离子,它是一种多原子离子。 h2o 还是 h3o 酸性更强?H3O+ 是 H2O 的共轭酸。 共轭酸总是比共轭碱更有效。 无论质子供体如何,第一个质子总是比第二个更容易去除。 为什么H3O+是酸性的?可以在水环境中共存的最强酸是 H3O+ (H+)。 因此,作为碱的反应物 H2O 将受益于该系统中的平衡。 水 (H2O) 可以作为两性物质,直到它发生任何反应,使其成为酸或碱,具体取决于它与什么反应。 然而,最纯净的水始终是中性的,因为它的 pH 值为 7,并且具有相同数量的 H+ 和 OH- 离子(既不是酸性也不是碱性)。 H3O+ 是如何酸性的?H3O+ 是在水性环境中存在于水中的最强酸。 结果, 系统中存在的平衡 对反应物 H2O 是有用的,它是两性的。 h3o 是中性的吗?不,酸是提高水系统中 H3O+ 浓度的物质。 这应该写成 H3O+,因为 OH- 和氢离子是更好的表示。 为什么 H3O 是中性的?水变成 H3O+,一种酸,当它作为碱时,它被称为水的共轭酸。 水溶液中最强的酸是 H3O+。 由于酸性溶液中 H3O+ 过多,OH- 减少。 由于碱性溶液中的 OH- 过多,H3O+ 会减少。 h3o 是稳定的还是不稳定的?H3O+ 在水溶液中是一种稳定的离子,与强酸的非电离形式不同,但它会与碱相互作用形成弱酸性水。 结果,当等量的强碱 OH- 和 H3O+ 形成,然后反应生成重整水时,纯水中达到平衡。 为什么 H3O+ 稳定?在室温下,所有水溶液都具有碱 (OH-) 和酸 (H+) 有效离子。 较低的 pH = 较少的酸。 更多的碱等于更高的pH。 以 7 次方表示的 H+ 离子浓度的倒数产生 XNUMX 的 pH 中性值。 H3O+ 的稳定性如何?具有空 1s 轨道且最多可容纳两个电子的质子称为 H+ 离子。 它非常想要一个电子,以至于它沉到了地球的中心。 事实上,正电荷现在均匀分布在所有 H 原子中,整个分子是 H3O+。 更稳定的离子之一是 H3O+。 第一个水分子对于理解世界海洋的化学性质至关重要,它将吸引其他水分子。 h3o+ 是对称的还是不对称的?H3O+ 是不对称的,因为 H3O+ 具有四面体结构和八个总价电子,三个 H 原子和 O 中的每一个都必须通过键连接,而 O 具有单对电子。 为什么 H3O+ 是不对称的?H3O+ 有 3 个键和 1 个孤对,但正因为如此,它的形状是三角形平面。 在检查分子时,一定要确定您是在寻找形状还是电子排列不对称的极性分子。 H3O+ 是如何不对称的?路易斯结构有八个电子,当它被绘制时,氧通过三个键和一个孤对电子与另外两个原子相连。 四面体分子几何结构源于 4 个电子域的存在。 由于氧原子上存在一对孤对,分子获得三角锥体形状。 四个电子密度区域使 H3O+ 具有不对称的四面体电子排列。 h3o+ 是平面的吗?由于分子不对称,呈三角几何形状,因此不是平面分子,呈sp3杂化的四面体结构。 为什么 H3O+ 不是平面的?三个氢原子和一个氧原子构成了水合氢离子的三角锥几何形状。 氧具有这种形状是因为它上面有一对电子。 测量原子之间的 113 度键角。 h3o+ 是质子吗?氢原子与 H2O- 中的氧、NH3- 中的氮或氟化物结合,使溶剂在 HF 溶剂中成为质子。 在质子溶剂中可以产生强大的分子间作用力。 此外,质子 (H+) 可以从这些 OH 键中获得。 因此,HXNUMXO+ 是质子的并表现出酸性和极性。 h3o+ 是三角锥体吗?是的,H3O+ 具有三角锥体结构或四面体几何形状,由空间数为 3 的 sp4 杂化组成。 为什么 H3O+ 是三角锥体?H3O+ 的形状是金字塔形的,因为氧原子与三个氢原子相连。 氧原子也有一对电子。 孤对电子是位于原子轨道中但不直接参与键合的电子对。 H3O+ 金字塔是怎样的?氢离子中没有电子。 H3O+ 路易斯结构的氧原子中存在两个孤对电子。 配位共价键是由于氧原子共享其单对之一而产生的。 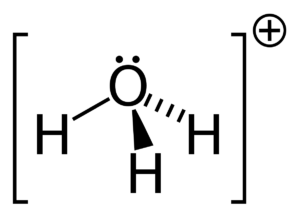 金字塔来自 维基媒体 金字塔来自 维基媒体结果,水合氢离子含有配位键,反应如下: H2O+H+ → H3O+ 因此 H3O+ 的形状是三角锥体。 结论水合氢离子的结构、键和杂化是本文的主要主题。 它还解释了水合氢离子具有多种用途,并提供了有关 H3O+ 路易斯结构和性质的大量深入知识。 |
【本文地址】