| 化学元素周期表外层电子排列规律 | 您所在的位置:网站首页 › 原子结构示意图大全初一 › 化学元素周期表外层电子排列规律 |
化学元素周期表外层电子排列规律
|
化学元素周期表最外层电子排列规律
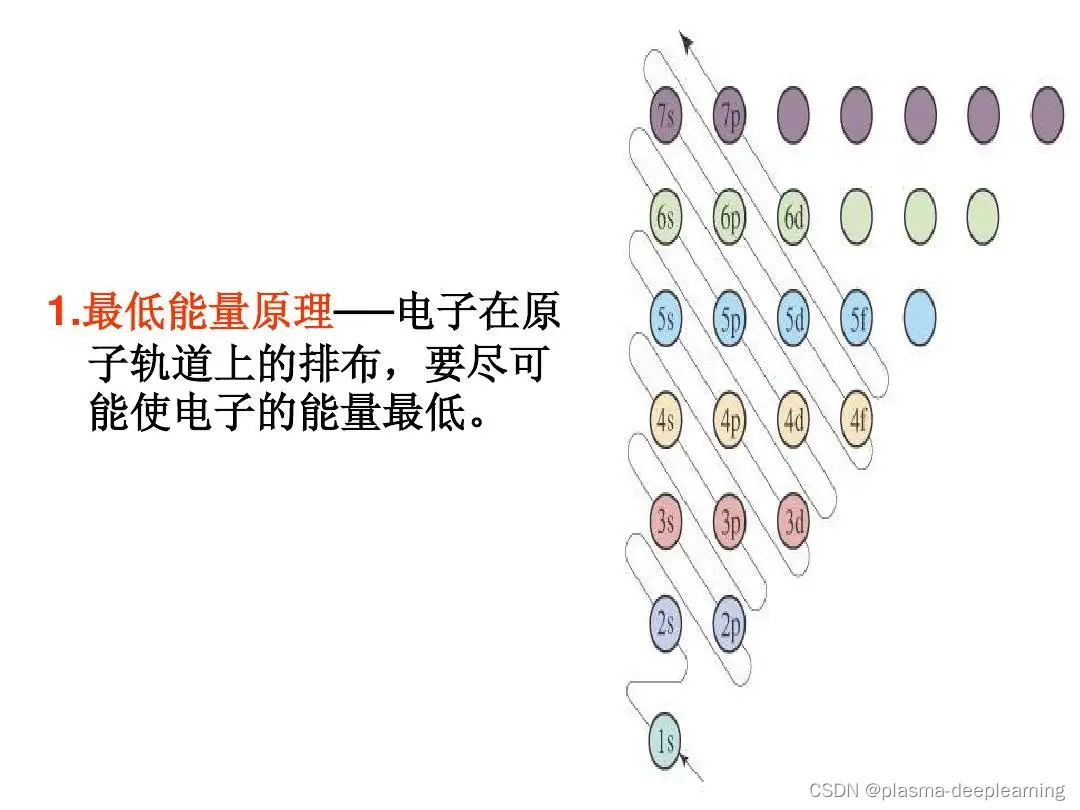
一、原子核外电子排布的原理1.最低能量原理2.泡利不相容原理3.洪特规则
二、核外电子排布的方法
一、原子核外电子排布的原理
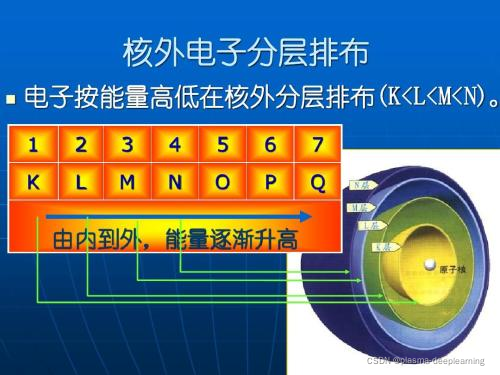
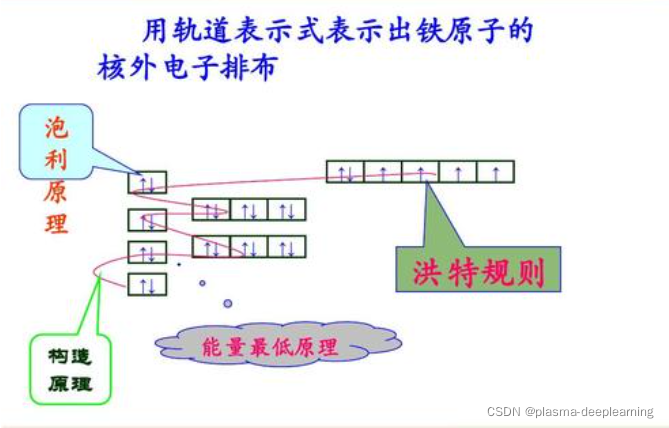
一般来说处于稳定状态的原子,核外电子将尽可能按照能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守泡利不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况。 1.最低能量原理电子在原子核外排布时,要尽可能使电子的能量最低。怎样才能使电子的能量最低呢?这就跟物体势能类似,在越高处具有的势能越高,物体总有从高处往低处的一种趋势,但不会自发的从低处往高处运动,如果要一个物体从地面到空中,则必须要有外力的作用。电子本身就是一种物质,也具有同样的性质,它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。当有外力作用时,电子可以吸收能量到能量较高的状态(激发态),但它总有回到基态的趋势。一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;原子中电子所处的不同能量状态称原子轨道的能级。根据原子轨道能级的相对高低,可划分为若干个电子层,K、L、M、N、O、P、Q…. , 一个电子的运动状态可以从4个方面来进行描述——电子层、电子亚层、电子云的伸展方向&电子的自旋方向。在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是泡利不相容原理。根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反。也就是说,每一个轨道中只能容纳两个自旋方向相反的电子。根据泡利不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;d亚层有5个轨道,总共可以容纳10个电子 。我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2*n^2个电子。 洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行; 洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于 全满(s2、p6、d10、f14) 氮(N)半满(s1、p3、d5、f7) 氮(N)全空(s0、p0、d0、f0)时比较稳定。 像铁离子Fe3+(3d5)和亚铁离子Fe2+(3d6)对比看,从3d6→3d5才稳定,这和亚铁离子不稳定易被氧化的事实相符合,根据洪特规则铬的电子排布式应为1s22s22p63s23p63d54s1 下面我们运用核外电子排布的3个原则来讨论核外电子排布的几个实例。 1、氮(N)原子核外有7个电子,根据能量最低原理和保里不相容原理,首先有2个电子排布到第一层的1s轨道中,又有2个电子排布到第二层的2s轨道中。按照洪特规则,余下的3个电子将以相同的自旋方式分别排布到3个方向不同但能量相同的2p轨道中。氮原子的电子排布式为1s2 2s2 2p3。这种用量子数n和l表示的电子排布方式,叫做电子构型或电子组态,右上角的数字是轨道中的电子数目。 2、氖(Ne)原子核外有10个电子,根据电子排布三原则,第一电子层中有2个电子排布到1s轨道上,第二层中有8个电子,其中2个排布到2s轨道上,6个排布到2p轨道上。因此氛的原子结构可以用电子构型表示为1s2 2s2 2p6。这种最外电子层为8电子的结构,通常是一种比较稳定的结构,称为稀有气体结构。 3、钠(Na)原子核外共有11个电子,按照电子排布顺序,最后一个电子应填充到第三电子层上,它的电子构型为1s2 2s2 2p6 3s1。为了避免电子结构式书写过繁,也可以把内层电子已达到稀有气体结构的部分写成“原子实”,以稀有气体的元素符号外加方括号来表示,例如钠原子的电子构型也可以表示为[Ne]3s1 4、钾(K)原子核外共有19个电子,由于3d和4s轨道能级交错,第19个电子填入4s轨道而不填入3d轨道,它的电子构型为1s2 2s2 2p6 3s2 3p6 4s1或[Ar]4s1。 5、钙(Ca)的第19,20个电子也填入4s轨道,钙原子的电子构型为[Ar]4s2。 铬(Cr)原子核外有24个电子,最高能级组中有6个电子。 6、铬(Ar) 的电子构型为[Ar]3d5 4s1,而不是[Ar]3d4 4s2。这是因为3d5的半充满结构是一种能量较低的稳定结构。 洪特规则之一 洪特规则是在等价轨道(指相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同。
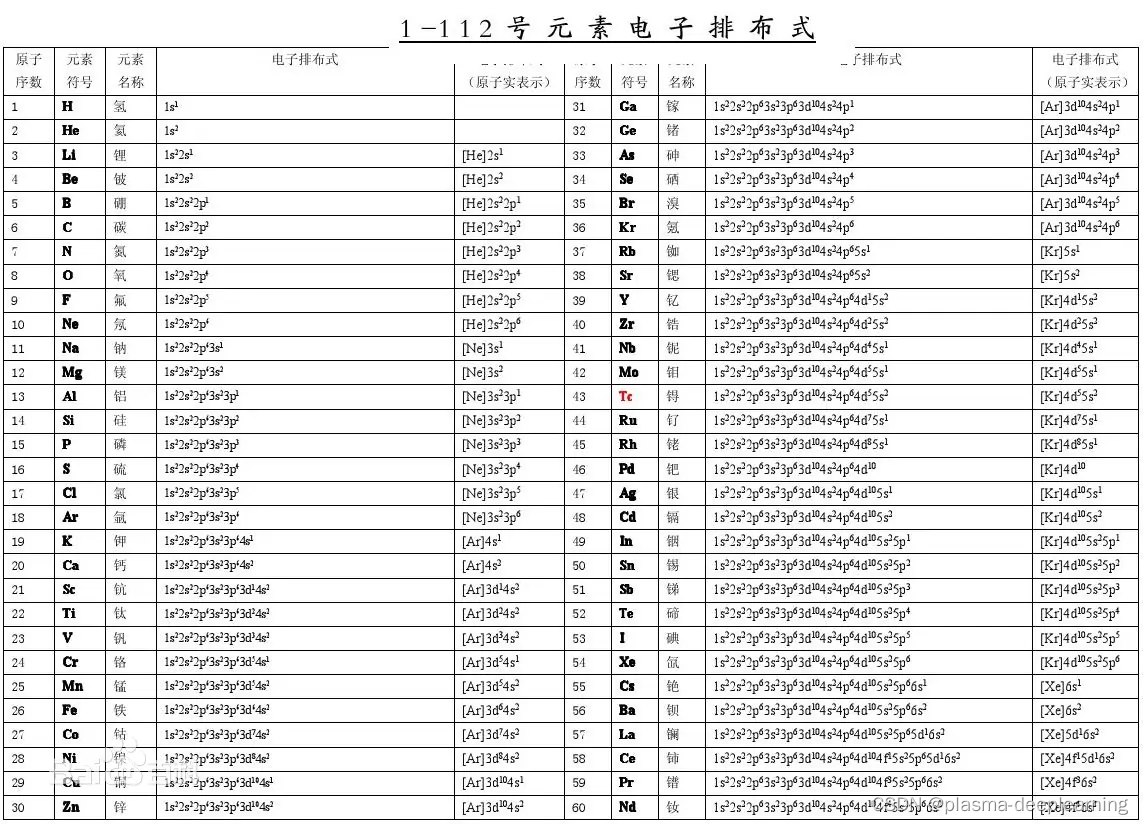
附:(1-112号化学元素电子排布式)
|
【本文地址】
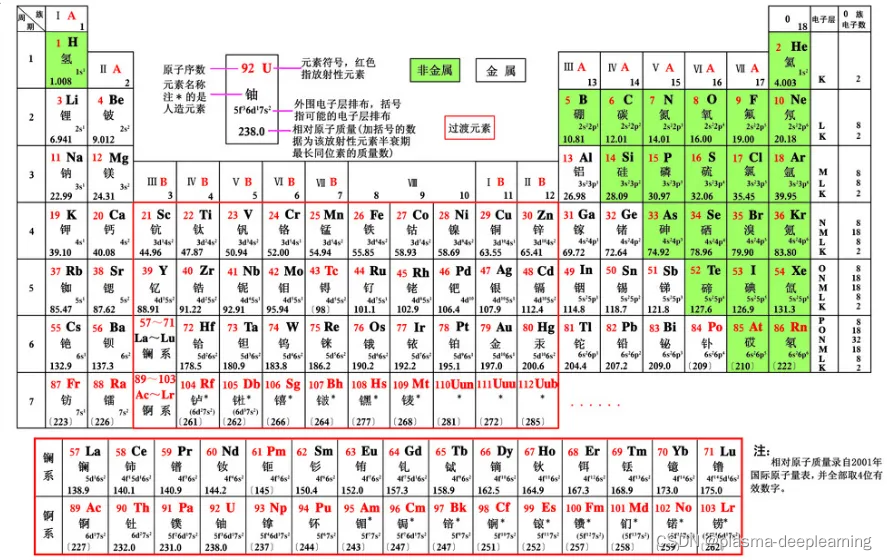
 同一层中又可以划分为若干个电子亚层,各亚层的能量是按s、p、d、f 的次序增高的。这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p……
同一层中又可以划分为若干个电子亚层,各亚层的能量是按s、p、d、f 的次序增高的。这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p……