| ICH GCP和中国GCP的跨时空对话 | 您所在的位置:网站首页 › 跨时空守护者 › ICH GCP和中国GCP的跨时空对话 |
ICH GCP和中国GCP的跨时空对话
|
ICH GCP和中国GCP于我们每个参与临床试验的人员而言,就像是为我们提供方向和指引的导航线,确保我们按照正确的流程与标准进行试验,朝向成功的目标前进。 那么,两者在时空跨度上,发展和更新进程是如何呢?其中有什么联系呢? 在制定ICH GCP之前,各国药品监管机构如欧盟、日本、美国等都有自己的临床试验指南,而ICH GCP的制定则是为了协调这些指南,以提供国际性的统一标准,对于加强临床试验的质量控制和数据的可比性具有重要意义。如下图,ICH GCP的制定始于20世纪90年代,距今已有20多年的历史。相比之下,中国的临床试验管理在20世纪90年代初期才刚刚起步。 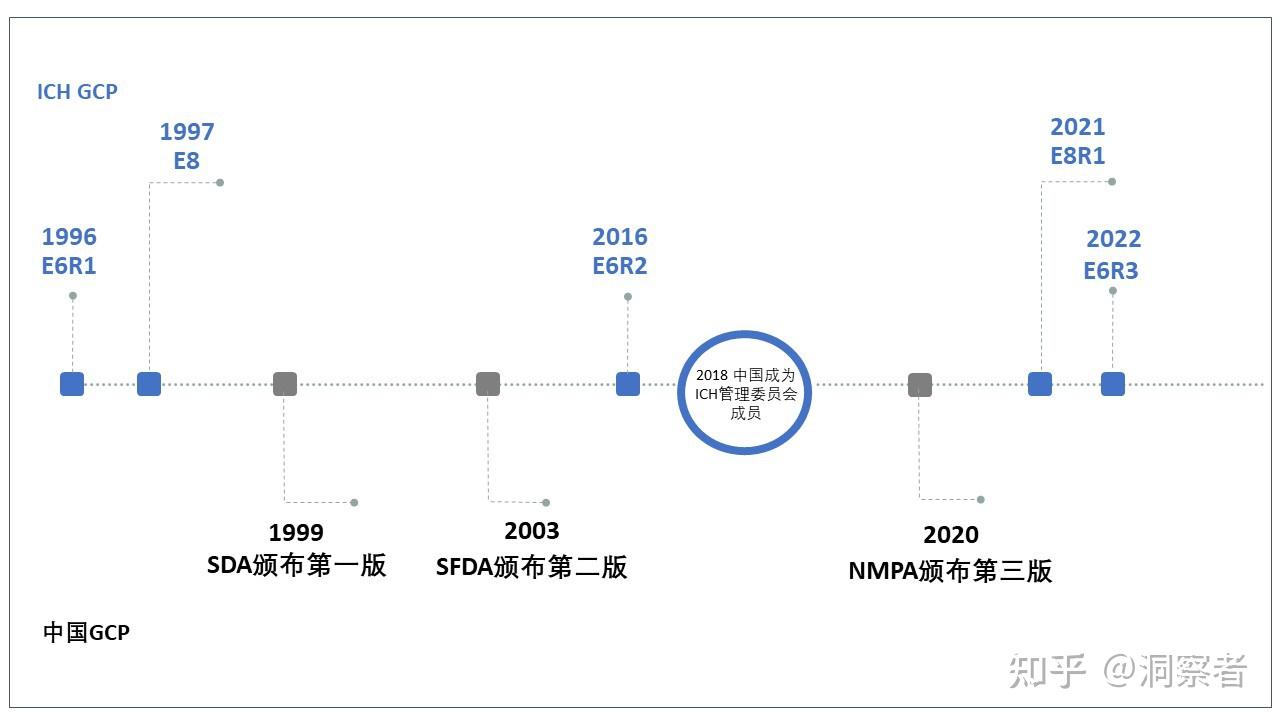 1996年,ICH GCP的第一版(E6R1)发布,强调了保护研究参与者权益、数据准确性和可靠性的重要性。它确立了临床试验的基本原则,包括伦理原则、试验设计和执行原则、记录和报告原则等。1997年,ICH GCP第一个补充指南(E8)发布(临床试验的一般性考虑),旨在提高临床试验的设计和计划质量,该补充指南的重点是对临床试验设计和统计学分析的指导。 此时,中国在承担国际多中心临床试验方面的角色越来越多,为规范管理和监管临床试验,提高临床试验质量,我国开始逐步建立起临床试验管理的法律、法规和指南,引入和接受国际上的相关标准和规范,其中包括ICH GCP。 1999年,中国国家药品监督管理局(SDA)发布了第一版中国GCP《药品临床试验管理规范》,基于ICH GCP并根据中国国情进行了调整和补充,对临床试验的伦理、试验药品管理、试验设计和数据分析等方面做出了详细规定。2003年,中国国家食品药品监督管理局(SFDA)发布了第二版中国GCP,与第一版相比,第二版GCP指导方针更加贴近ICH GCP的内容和要求,推动了中国临床试验质量的提高,主要针对临床试验质量监管和临床试验参与者权益保护进行了完善。 随着科技的不断发展和临床试验的不断演变,2016年,ICH GCP的第二版(E6R2)发布。此次更新引入了电子数据记录和病人安全监测等新内容,同时也更加重视试验参与者的知情同意和试验数据的保护。 2020年中国在药品监督体系大改革的背景下,组建了药品监督管理局(NMPA)。2020年NMPA发布了第三版中国GCP,该版指导方针进一步完善了临床试验的伦理原则、试验设计和执行、数据管理和报告等方面的内容。此外,第三版GCP指导方针还强调了人类基因编辑、特殊人群和药物不良反应等特殊领域的试验规范。 2021年,ICH GCP发布了第二个补充指南(E8R1),针对临床试验设计和计划质量的进一步完善,强调了风险评估和风险管理的重要性,旨在确保临床试验的质量和安全。2022年,ICH GCP的第三版(E6R3)发布,此次更新主要面向数字化技术和人工智能的应用,此外,还关注了多中心和跨国研究的要求,以及试验数据管理和共享的规范和标准。 随着时间的推移,ICH GCP和中国GCP之间的跨时空对话也在不断深化。ICH GCP的更新反映了不断变化的临床研究环境和监管要求,适应数字化技术、多中心和跨国研究的发展趋势,提高临床试验的效率和质量。中国在吸收和引入ICH GCP的同时,也在探索和推进临床试验管理的本土化创新和发展。从第一版到第三版,中国GCP指导方针逐渐与ICH GCP趋于一致,使得中国临床试验规范更贴近国际标准。 |
【本文地址】