| 分子轨道为什么同时存在成键轨道和反键轨道 | 您所在的位置:网站首页 › 成键轨道和反键轨道区别 › 分子轨道为什么同时存在成键轨道和反键轨道 |
分子轨道为什么同时存在成键轨道和反键轨道
|
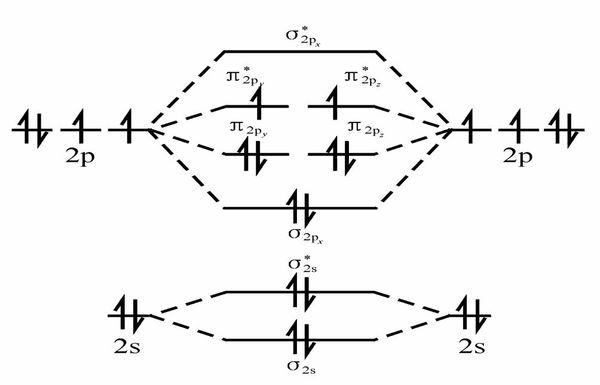
根据能量守恒的原则,生成的分子轨道中必然有能量的升高和降低,在组合产生的分子轨道中,能量低于原子轨道的称为成键轨道;高于原子轨道的称为反键轨道。分子轨道是由原子轨道进行线性组合而成,几个原子轨道就组合成几个分子轨道,有的原子轨道能量升高(组合成反键分子轨道),有的原子轨道能量降低(组合成成键分子轨道),还有的原子轨道能量不高也不低(组合成非键分子轨道)。因为能量不会凭空产生和消失,升高的总能量和降低的总能量相等,所以在生成了成键轨道的同时,会有反键或者非键轨道的生成。 扩展资料成键轨道、反键轨道组成分子轨道,这是由原子轨道进行线性组合后的结果。这种线性组合需要遵循以下三条基本原则:1、对称性一致原则对称性一致原则是指对核间连线呈相同对称性的轨道,才有可能进行线性组合。除s-s,p-p组合之外,还有s-p.沿x方向的组合,两者的对称性一致,可以组成σ分子轨道。2、能量相近原则能量相近原则是指轨道能量相近时彼此间才有可能进行线性组合。3、最大重叠原则最大重叠原理是指在对称性一致、能量相近的基础上,原子轨道重叠的程度越大,越容易形成分子轨道即生成成键轨道,或者说形成的共价键越强。参考资料来源:搜狗百科-分子轨道 |
【本文地址】
公司简介
联系我们