| Phenomics | 您所在的位置:网站首页 › blood的用法及搭配 › Phenomics |
Phenomics
|
近日,《表型组学》(Phenomics)在线发表了复旦大学人类表型组研究院钱峰团队题为Deep Immunophenotyping of Human Whole Blood by Standardized Multi‑parametric Flow Cytometry Analyses 的论文。 论文DOI链接: https://doi.org/10.1007/s43657-022-00092-9 论文pdf链接: https://link.springer.com/content/pdf/10.1007/s43657-022-00092-9.pdf 该研究设计了数个全新的、经过系统优化的11色流式细胞术抗体组合(Panels),对人体全血免疫细胞表型进行深度分析。该多色流式细胞术方案共包含51种经过验证的流式细胞术抗体,包括识别不同的免疫细胞亚群的细胞谱系标志物抗体,以及在鉴定免疫细胞亚群的同时评估其功能状态的细胞表面功能标志物抗体。为了确保数据的可靠性,该研究提供了一整套详细的标准操作程序,包括1)流式细胞仪参数优化,2)抗体滴定和样品染色,3)数据采集和质量检查。该套标准化操作体系具有良好的实用性,已被应用于多个队列研究中。该方案中的流式多色Panel在探索性研究中也可自由组合及拓展,有助于更好地研究人类免疫系统的复杂性。  图1 构建数个全新的11色多色流式细胞术Panel,对人体外周血主要免疫细胞亚群进行精细分型,实现人体免疫表型的深度刻画研究背景 图1 构建数个全新的11色多色流式细胞术Panel,对人体外周血主要免疫细胞亚群进行精细分型,实现人体免疫表型的深度刻画研究背景免疫系统是机体最重要的系统之一。随着免疫学和精准医学的不断发展,人们对免疫系统的复杂性有了更深刻的了解,认识到免疫系统在个体和群体间具有丰富的差异性,进一步深入理解免疫系统多样性亟需在人群层面解析免疫系统的组成和功能(即免疫表型)。 缺乏经过验证的高通量免疫表型检测体系是当前基于大型队列的免疫表型研究少而又少的重要原因。以单细胞测序为代表的检测技术由于其成本昂贵、样本要求严格,尚难以在大型队列研究中应用。流式细胞术可在单细胞水平对细胞进行快速多参数分析,具有检测速度快、测量指标多、采集数据量大等特点。作为免疫学领域最重要的分析手段之一,流式细胞术近年来发展快速,新的抗体、荧光染料和高性能流式细胞仪的普及,越来越多的标志物可以同时被检测,使精细免疫细胞亚群的分型成为可能。然而,多色流式细胞术存在抗体组合设计、溢出扩散、样本处理、荧光补偿、仪器性能和数据分析等诸多问题。开发一个完全优化的多色流式细胞术抗体组合是一个耗时耗力的工作,而且需要标准化的操作程序才能获得可靠的结果。 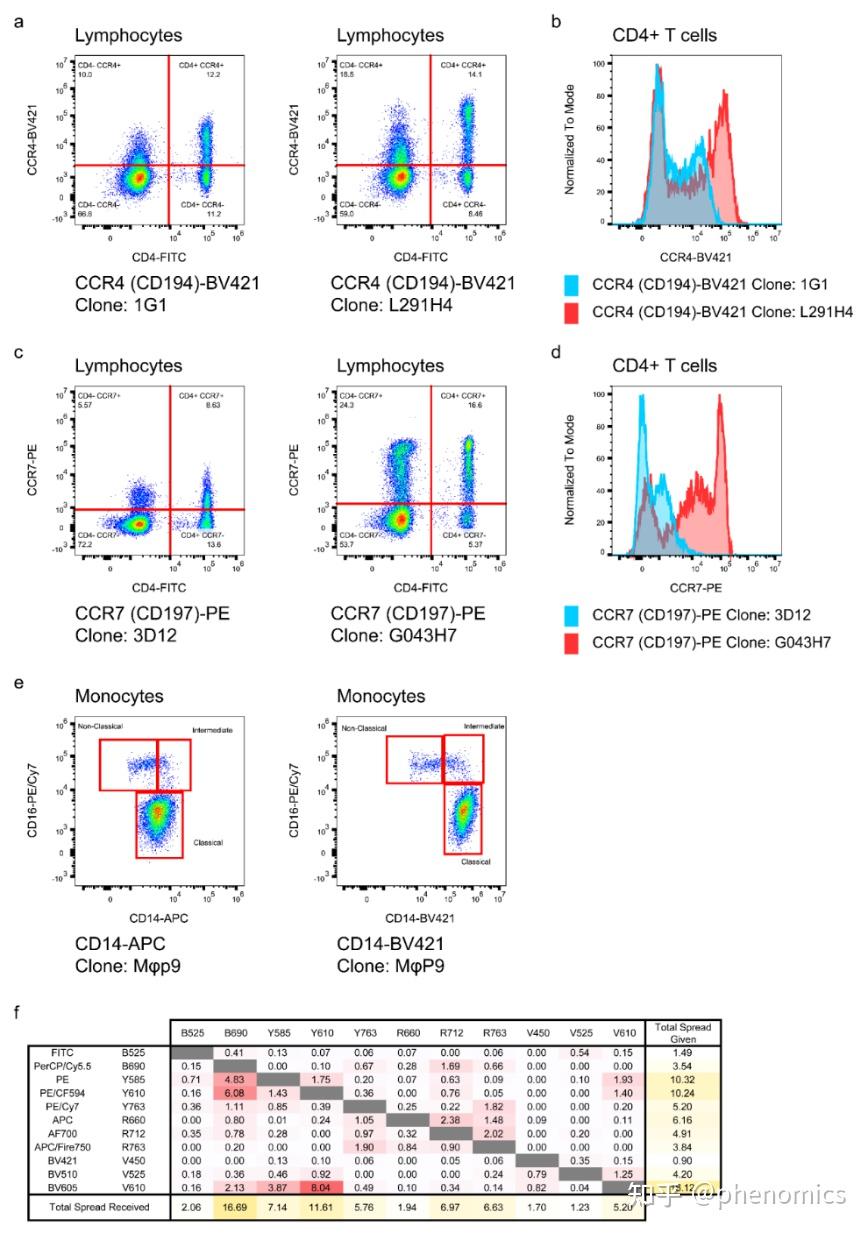 图2 高维流式细胞术Panel开发过程中需要注意对抗体的荧光素和克隆号进行选择研究结果 图2 高维流式细胞术Panel开发过程中需要注意对抗体的荧光素和克隆号进行选择研究结果经过深入评估不同抗体荧光素和克隆号的染色效果,结合流式细胞仪配置,该研究开发并验证了数个不同的11色流式细胞术Panels。该套方案能够对人体外周血中包括固有免疫细胞和获得性免疫细胞等主要的免疫细胞亚群进行精细分群,如中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞、树突状细胞、自然杀伤细胞、T细胞和B细胞等,还可以对重要免疫细胞的功能状态进行评估和刻画。 同时,该研究还提供了一整套标准操作程序,包括1)流式细胞仪检测通道线性度计算和增益优化策略,2)抗体滴定、补偿设置和样本染色程序,以及3)数据采集和质控程序。 01 粒细胞、单核细胞、树突状细胞 图3 粒细胞,单核细胞和树突状细胞圈门策略 图3 粒细胞,单核细胞和树突状细胞圈门策略该研究开发的Panel 1用于检测粒细胞、单核细胞和树突状细胞。在圈门策略上,所有Panel的一个通用策略是首先使FSC-A分别与FSC-H和FSC-W搭配,双重检查去除粘连体细胞,再通过CD45这一白细胞共同抗原识别出CD45+细胞(图3a)。通过使用CD16来区分CD15+群体中的嗜酸性粒细胞和中性粒细胞(图3b),而嗜碱性粒细胞被定义为Lineage (CD3/CD14/CD19/CD56)− HLA-DR−CD123+。进一步根据CD11c和CD123的差异表达,将Lineage-HLA-DR+群体区分为髓样树突状细胞(mDCs)和浆细胞样树突状细胞(pDCs)(图3d)。单核细胞是急性感染中对病原体快速反应的免疫细胞。通过CD14和CD16的表达不同区分单核细胞不同的分化阶段:经典单核细胞(CD14hi CD16−)、中间单核细胞(CD14hi CD16+)和非经典单核细胞(CD14+ CD16hi)(图3c)。更进一步,可以通过CD64、CD86、CD38和HLA-DR的表达来评估不同粒细胞、单核细胞和树突状细胞亚群的功能状态(图3e)。 02 非常规T细胞和NK细胞 图4 非常规T细胞和NK细胞圈门策略 图4 非常规T细胞和NK细胞圈门策略非常规T细胞是一组相对较少的淋巴细胞,但在生理和病理中同样发挥了许多重要作用。在该Panel中,如前所述,首先去除粘连体并圈出CD45+细胞,在此基础上,通过CD3将淋巴细胞分为CD3+ T细胞和CD3-细胞。在CD3+T细胞中,通过TCR γδ和TCR Vδ2鉴定了γδ T细胞及其亚群(图4b)。另一方面,MAIT细胞(图4c)和NKT细胞(图4e)也通过其表面标志物在CD3+ T细胞中被圈出。同时,该方案还查看了在αβ T细胞、CD8+ T细胞和CD8− T细胞中的MAIT细胞(图4d)和 NKT 细胞(图4f)。NK 细胞是具有杀伤功能的一类免疫细胞。常见的NK细胞鉴定策略是CD3- CD56+,并将其分为CD56bright NK细胞和CD56dim NK细胞(图4g)。但有研究指出,还存在一类并不表达CD56的NK细胞,尤其是在慢性病毒感染患者的外周血中。因此,该文章还提供了一种基于NKp46的NK细胞圈门策略,Terminal NK细胞即为CD56-的NK细胞(图4h)。该Panel还评估了两个细胞表面受体NKG2D和NKp46在不同免疫细胞亚群上的表达情况(图4h)。 03 T细胞亚群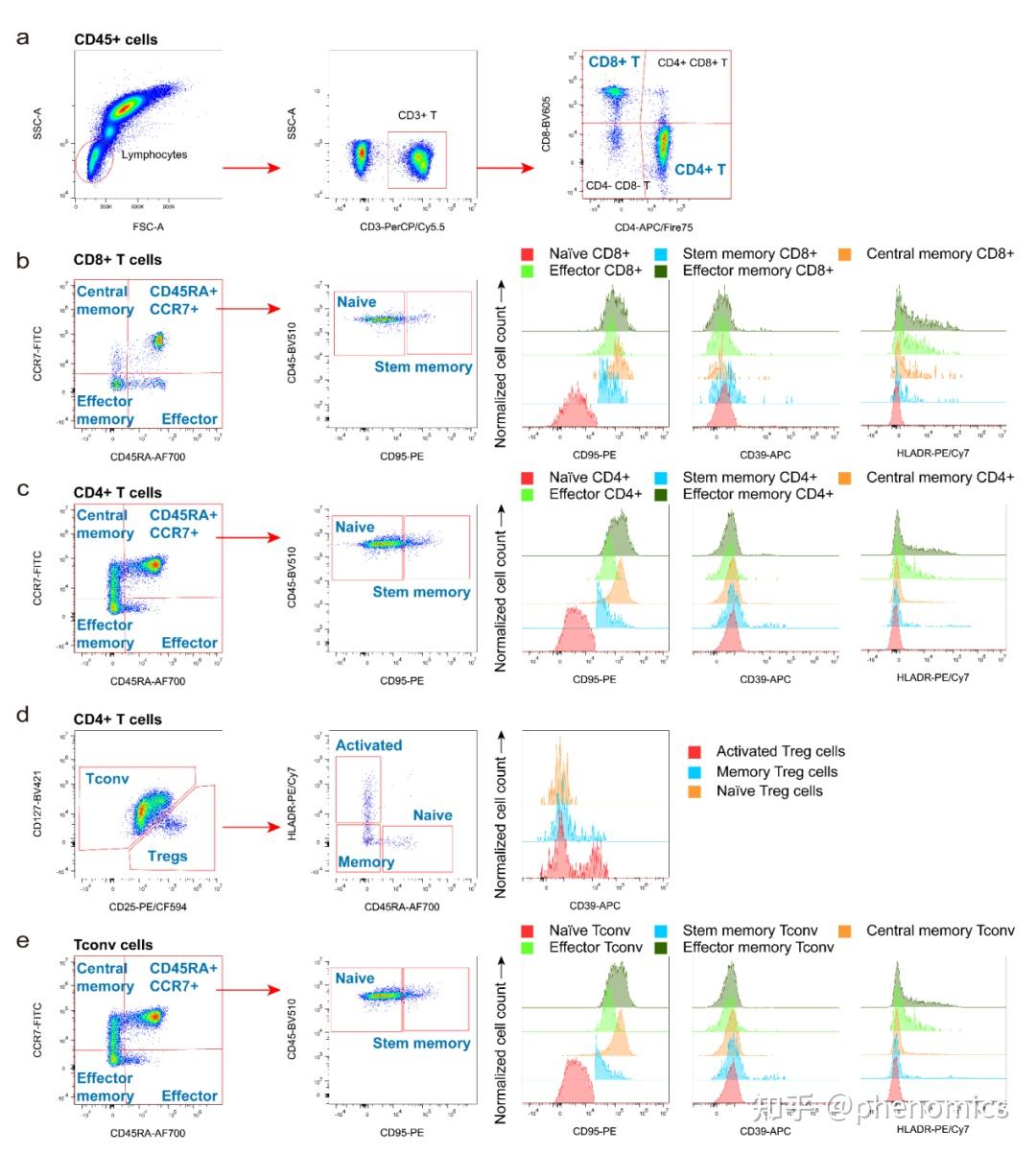 图5 不同成熟阶段T细胞亚群及Treg细胞圈门策略 图5 不同成熟阶段T细胞亚群及Treg细胞圈门策略T细胞介导细胞免疫,是一群高度异质性细胞。该研究在Panel 2、Panel 3和Panel 5中鉴定了T细胞的大部分亚群,同时在Panel 4通过不同的表面标志物评估了它们的功能状态。在Panel 3、Panel 4和Panel 5中,通过经典的T细胞表面标志物(CD4和CD8),将总CD3+ T细胞分为四个亚群,即CD4+ T细胞、CD8+ T细胞、双阴性T细胞(CD4− CD8− T细胞)和双阳性T细胞(CD4+ CD8+ T细胞)(图5a)。在Panel 3中,进一步通过CD45RA、CCR7和CD95的表达对CD8+ T细胞(图5b)和CD4+ T细胞(图5c)的不同成熟状态进行识别,细分为幼稚T细胞(CD45RA+ CCR7+ CD95-)、干细胞样记忆T细胞(CD45RA+ CCR7+ CD95+)、效应T细胞(CD45RA+ CCR7-)、中央记忆T细胞(CD45RA- CCR7+)和效应记忆T细胞(CD45RA- CCR7-),并评估了表面标志物(CD95、CD39和HLA-DR)在不同成熟阶段的T细胞亚群上的表达水平。另一方面,Treg细胞则通过CD25hi CD127−/low的表达特征在CD4+ T细胞内被识别出来,进一步Treg细胞还可以通过CD45RA和HLA-DR两个标志物被细分为幼稚Treg细胞(CD45RA+ HLA-DR-)、记忆Treg细胞(CD45RA- HLA-DR-)和活化Treg细胞(CD45RA- HLA-DR+),对不同Treg细胞亚群上CD39的表达也同时进行了分析(图5d)。圈门策略中,非Treg细胞,即CD4+的常规T细胞也被细分为不同成熟阶段的亚群,并评估了功能标志物的表达(图5e)。  图6 激活、抑制及耗竭等标志物在不同T细胞亚群的表达 图6 激活、抑制及耗竭等标志物在不同T细胞亚群的表达为了确定T细胞及其亚群(CD4+ T细胞、CD8+ T细胞、CD4− CD8− T细胞和 CD4+ CD8+ T细胞)的不同功能状态,该研究在Panel 4中分析了经典的T细胞激活标志物CD69、CD28、HLA-DR和CD38的表达(图6a),以及抑制性受体(CD85j)、耗竭标志物PD-1和终末衰老标志物CD57的表达(图6b)。其中CD85j+ T细胞已在既往研究中被证明与衰老相关;PD-1在T细胞活化时上调,以防止过度免疫反应;CD57是终末分化的标志物,与自身免疫性疾病、感染性疾病和癌症相关。  图7 不同Th、Tc、Tfh和Treg细胞亚群圈门策略 图7 不同Th、Tc、Tfh和Treg细胞亚群圈门策略在Panel 5中,该研究进一步对T细胞亚群进行精细分群。根据趋化因子受体CXCR3、CCR4和CCR6的表达,CD4+ T细胞被进一步区分为Th1(CXCR3+ CCR4− CCR6−)细胞、Th2(CXCR3- CCR4+ CCR6−)细胞、Th9(CCR4- CCR6+)细胞、Th17(CXCR3- CCR4+ CCR6+)细胞以及Th17/Th1(CXCR3+ CCR4- CCR6−)细胞(图7a)。同时,根据CXCR5的表达,可以在CD4+ T细胞中识别出Tfh细胞(图7b)。类似的,可以在Treg细胞(图7c)和CD8+ T细胞(图7d)中识别出Tfr细胞和 CXCR5+ CD8+ T细胞。进一步,通过典型多元分析,根据趋化因子受体的表达,分别在Tfh细胞(图7e)、Treg细胞(图7f)和CD8+ T细胞(图7g)中识别出不同的Th样亚群。此外,研究人员还分析了不同T细胞亚群上ICOS的表达情况(图7h)。 04 B细胞亚群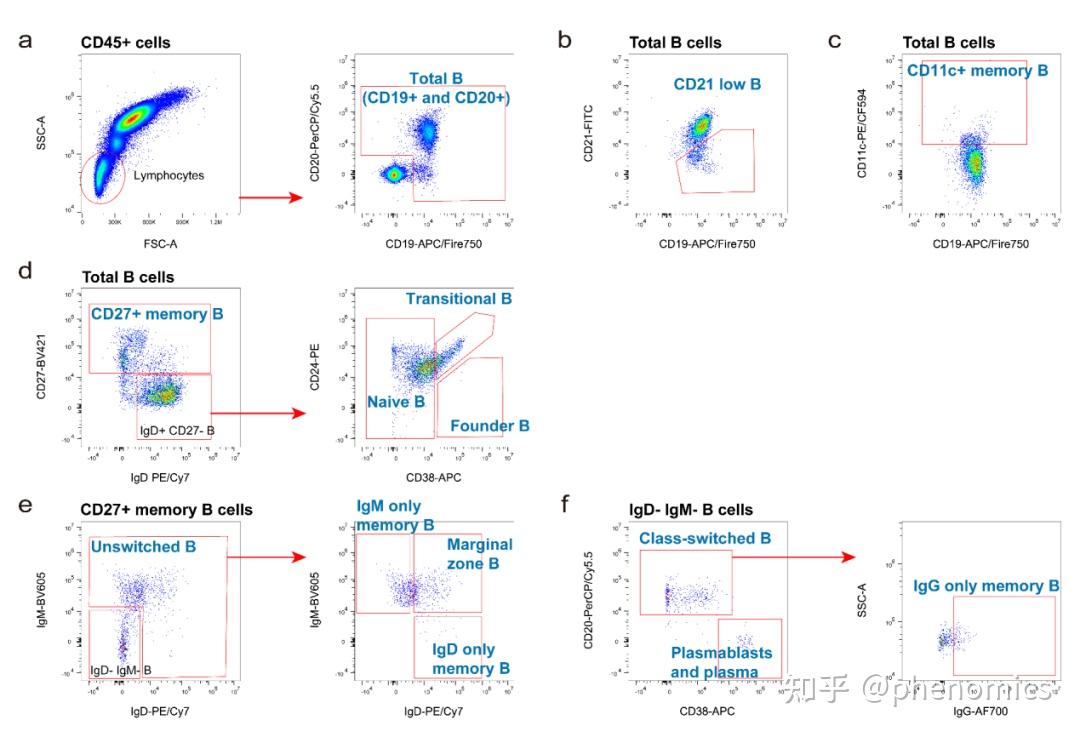 图8 B细胞亚群圈门策略 图8 B细胞亚群圈门策略研究人员在Panel 6中对B细胞这一重要免疫细胞进行了精细分型。该研究纳入了两个泛B细胞标志物:CD19和CD20,以对总B细胞进行识别(图8a)。进一步分别鉴定了两个B细胞亚群,分别是CD21−/low B细胞(图8b),以及CD11+ 记忆B细胞(图8c)。根据B细胞的发育轨迹,该研究通过IgD、CD27、CD38和CD24的表达特征对CD27+ 记忆B细胞、幼稚B细胞、过渡性B细胞和前体B细胞进行识别(图8d)。进一步根据IgD和IgM的差异表达,鉴定了未转换B细胞、边缘区B细胞、IgD+ 记忆B细胞和IgM+ 记忆B细胞(图8e)。此外,在IgD− IgM− B细胞中对浆母细胞和浆细胞、经典转换B细胞及IgG+ 记忆B细胞进行识别(图8f)。 研究结论在该篇论文中,研究人员开发了基于人体外周血多色流式细胞术的免疫表型检测标准化工作流程,通过多个全新的11色多色流式细胞术Panels,对人体外周血主要免疫细胞亚群进行精细分型,实现人体免疫表型的深度刻画。 与其他研究开发的多色流式细胞术Panel相比,该方案纳入了粒细胞(中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞)、非常规T细胞(γδT细胞、NKT细胞、MAIT细胞)和多种Th样细胞的识别和分析,是当前检测免疫细胞亚群最多的方案之一,具有新颖性、实用性和可复制性。该研究优化后的免疫表型检测操作程序,是流式细胞术标准化通用方案,其他科研机构研究人员可参照该方案快速建立适合自身仪器的标准化工作流,并通过有限的步骤获得更好的免疫表型数据再现性。 AbstractImmunophenotyping is proving crucial to understanding the role of the immune system in health and disease. High-throughput flow cytometry has been used extensively to reveal changes in immune cell composition and function at the single-cell level. Here, we describe six optimized 11-color flow cytometry panels for deep immunophenotyping of human whole blood. A total of 51 surface antibodies, which are readily available and validated, were selected to identify the key immune cell populations and evaluate their functional state in a single assay. The gating strategies for effective flow cytometry data analysis are included in the protocol. To ensure data reproducibility, we provide detailed procedures in three parts, including (1) instrument characterization and detector gain optimization, (2) antibody titration and sample staining, and (3) data acquisition and quality checks. This standardized approach has been applied to a variety of donors for a better understanding of the complexity of the human immune system. 通讯作者 钱峰,复旦大学人类表型组研究院副研究员,博士生导师,上海国际人类表型组研究院免疫表型组研究所副所长。2013年回国就职于复旦大学生命科学院,2019年进入复旦大学人类表型组研究院,建立人类表型组研究院细胞表型平台,主攻免疫组学研究。近年来获得国家基金委、科技部、教育部等项目资助。在Aging Cell, EMBO J,mBio, Curr Opin Immunol等期刊发表SCI论文50余篇,论文累计引用4000余次。 第一作者 高健,复旦大学人类表型组研究院博士后。2017年毕业于安徽师范大学应用生物科学专业,获农学学士学位;同年进入复旦大学生命科学学院攻读博士学位,师从钱峰副研究员,于2023年获遗传学博士学位。 主要研究方向为免疫表型的标准化检测方法开发与应用、个体和环境因素对人体免疫表型的影响。主要设计开发了基于标准化多色流式细胞术的人体外周血免疫表型深度检测实验体系,该方案包含六个11色的多色流式细胞术面板,已应用于“国际人类表型组计划(一期)”上海核心队列免疫表型的研究,生成了上千人的免疫表型数据。 近三年以第一作者和共同作者在Phenomics、BMC Medicine、Clinical and Translational Medicine等期刊发表研究论文,参与申请发明专利两项,参与制定两项免疫细胞流式检测法团体标准(已发布实施)。 Phenomics期刊简介 Phenomics是一本新创的同行评审国际期刊,聚焦表型组学前沿研究,搭建全球表型组学领域专家交流的国际平台,推动该领域相关的理论创新和学科发展。 本期刊拥有强大的国际编委团队,复旦大学金力院士担任主编,美国系统生物学研究所Leroy Hood院士、澳大利亚莫道克大学Jeremy Nicholson院士、德国莱布尼兹环境医学研究所Jean Krutmann院士、复旦大学唐惠儒教授共同担任副主编,复旦大学丁琛教授担任执行主编,另有来自全球多国的三十多位著名科学家共同组成编委团队,以及四十多位青年科学家组成青年编委团队。 我们诚挚地邀请广大科研人员投稿! Phenomics官网: https://www.springer.com/journal/43657 投稿链接: https://www.editorialmanager.com/pnmc/ 编辑部邮箱:[email protected]、[email protected] 欢迎关注Phenomics官方公众号
|
【本文地址】